Поколение графта. Тканевая инженерия — окно в современную медицину Клеточная инженерия костной ткани
Что если бы мы могли отращивать части тела, словно морская звезда? Фантазия это или реальность? «К & З» решил разобраться, что представляет собой тканевая инженерия, и, самое главное, доступна ли она в России.
Что такое тканевая инженерия
На самом деле наш организм способен к регенерации, более того, он занимается этим каждый день: кости восстанавливаются каждые десять лет, а кожа меняется каждые две недели. Но этого, конечно, недостаточно. Из-за болезней, травм и просто с возрастом наши ткани и целые органы разрушаются и умирают. Как замедлить этот процесс и восстановить то, чего уже нет? Этими вопросами занимается передовое направление регенеративной медицины - тканевая инженерия, позволяющая наращивать утраченные кожные покровы и части органов, например, сердца или мочевого пузыря.
Для чего необходима тканевая инженерия
Некроз ткани ввиду болезни, травмы или врожденных аномалий - проблема номер один в сфере здравоохранения по всему миру. Потребность в трансплантации растет в арифметической прогрессии во всех странах. Классическая современная медицина вылечить многие хронические заболевания на данный момент неспособна - возможны только коррекционные процедуры, однако найти полностью совместимого донора - это тоже вызов.
Сегодня одним из основных методов восстановления органов и тканей в случаях, когда пересадка собственного материала невозможна, остается его трансплантация - от живого донора или недавно умершего человека. Главное в этом процессе - максимальная биологическая совместимость донора и реципиента. Но и в этом случае иммунная система будет сопротивляться и мешать приживлению пересаженного органа или ткани. Потому пациентам, перенесшим трансплантацию, временно или пожизненно назначают специальные препараты - иммунодепрессанты. По сути, они подавляют собственную иммунную систему человека. Но, несмотря на многие усилия, очень часто пересаженный орган не приживается.
Следуя принципу «не навреди», ученые и врачи давно искали способы восстанавливать ткани и органы силами собственного организма пациента. Для этого появился целый раздел реконструктивной хирургии, основанной на микрохирургических техниках. Пришить или пересадить палец при травме, например, с ноги на руку, восстановить молочную железу после удаления злокачественной опухоли и даже вернуть пациенту значительную часть лица - после травмы, онкологии или ранения. Но микрохирургия не всесильна. Так начала расцветать тканевая инженерия, которая появилась задолго до микрохирургии.
Немного из истории вопроса
Впервые об этом еще в конце XIX века задумался американский врач Лео Лёб. В 1897 году он провел эксперимент: наблюдал, как в свернувшейся крови и лимфе делились клетки. Опубликовав свои наблюдения, он, однако, не раскрыл точных параметров опыта, чем сделал эту работу еще более интригующей. Вслед за ним к этой теме с разных сторон пытались подойти многие ученые, но лишь спустя десять лет его коллеге и соотечественнику - ученому Россу Харрисону - удалось вырастить и поддерживать живыми нервные волокна и клетки, взятые из ткани эмбриона лягушки. А уже в 1912 году французский хирург Алексис Каррель вместе с коллегами смог поддерживать жизнь небольшого участка сердца куриного эмбриона. Этот биоматериал оставался жизнеспособным и даже рос в течение 24 лет!
Способы выращивания ткани
С тех пор тканевая инженерия продвинулась далеко вперед. Сейчас для выращивания ткани используются разные способы, но один из основных - scaffold - скаффолд-технология . Экспериментаторы из разных стран практикуют ее с 90-х годов. По этой технологии за образец берутся клетки живого организма: кусочек ткани или какой-то отдельный орган. Затем с помощью ферментов его разбирают на отдельные клетки и культивируют их в течение четырех - шести недель.
Следующий этап - пересадка размножившихся клеток на скаффолд, специальную временную матрицу. Внешне скаффолд можно принять за хлопчатобумажную ткань, вполне подходящую для блузки или рубашки, но на самом деле это сложно сконструированный искусственный материал. На таком каркасе выращивается биоматериал, предназначенный для пересадки человеку. Конструкция имплантируется туда, где отсутствуют ткани, например, на уретру или почку. Скаффолд выступает как своеобразный курьер для новых клеток. Как только поврежденная ткань восстанавливается, доставщик рассасывается, исчезая без следа.
Яркий пример такой работы - реконструкция мочевого пузыря американским хирургом Энтони Аталой для Люка Масселлы, десятилетнего мальчика с врожденным пороком развития позвоночника - расщеплением. Болезнь парализовала мочевой пузырь ребенка, и к моменту, когда родители обратились к врачу за помощью, почки уже отказывали. «На вырост» взяли ткань мочевого пузыря размером с половину почтовой марки. Культивация клеток в лабораторных условиях заняла четыре недели. Затем команда Аталы создала скаффолд в форме мочевого пузыря, внутреннюю оболочку этого каркаса покрыли клетками, выстилающими «оригинальный» орган, а внешнюю - мышечными. Модель поместили в биореактор (медицинский аналог печи) для дозревания. Через шесть - восемь недель полностью сформировавшийся орган был пересажен. Таким же замысловатым способом Атале удалось вырастить сердечный клапан и даже ухо. С ним, кстати, пришлось повозиться: в форму был посеян хрящ пациента, который, пробыв в биореакторе несколько недель, превратился в самостоятельное скаффолд-ухо. Для более сложных органов, например сердца, коллега Аталы китайский ученый Тао Жу разработал технику, при которой используются 3D-принтеры. Вместо чернил в картриджи заливаются человеческие клетки, из которых в течение часа буквально печатается сердце, и уже через 46 часов оно готово к использованию.
В качестве каркаса применяются и донорские органы. Возьмем печень: с помощью специальных средств из нее удаляют все клетки донора, потом в опустошенный «скелет» вводятся клетки пациента - изнутри и снаружи. Клетки пациента - гарантия того, что отторжения со стороны организма не будет. Тканевая инженерия пока относится к экспериментальной науке, но уже имеющиеся опыты доказывают: создавать с помощью данной методики можно все - сердечные клапаны, кровеносные сосуды, печень, мышцы, уши и пальцы человека. Ученые надеются, что новая методика поможет также справиться с еще одной острой проблемой трансплантологии - дефицитом донорских органов.
Аутотрансплантация в эстетической медицине
Сегодня обычная аутотрансплантация широко применяется при ожогах, травмах хрящей, сухожилий и даже костей. На данный момент тканевая инженерия на уровне медицины красоты не может предложить каких-то выдающихся вещей, но кое-что есть. В эстетической медицине широко применяют операцию аутотрансплантации хрящевой и жировой ткани. Собственная хрящевая ткань гораздо лучше приживается при ринопластике и позволяет гибко моделировать форму носа. При гениопластике с помощью своей ткани можно легко сменить угол подбородка. Установка хрящевых имплантатов используется и в малярпластике для увеличения объема скуловой области.
Регенеративная медицина в России
В России ситуация с тканевой инженерией не такая радужная, органы никто пока не выращивает, есть регенеративные техники в кардиологии, используется экстракорпоральная гемакоррекция. Проводятся эксперименты по 3D-печати, но на данный момент даже с юридической точки зрения проводить такие операции невозможно.
Регенеративная медицина, в частности выращивание стволовых клеток вне человеческого тела, одно из главных и важных событий в мировой практике. Совсем недавно, в 2014 году, ученым из Института физико-химических исследований Японии удалось вернуть зрение 70-летней женщине, а в этом году японцы смогли вырастить кожу, волосяные луковицы и мини-печень. Уже сейчас медицине доступно выращивание хрящей, тканей и некоторых цельных органов. Не за горами - сердце, поджелудочная железа и нервная ткань, мозг. Пока что статистика не радует: в минуту в мире умирают два человека, которых можно было бы спасти с помощью пересадки собственной ткани. Аутотрансплантация - это будущее, с помощью которого можно будет спасти миллионы жизней.
Мезенхимальные стволовые клетки обладают возможностью попадать в пораженные ткани организма, и это уже доказано. Эта способность МСК используется учеными для доставки лечебных генов и лекарств в ткани.
Системно введенная стволовая клетка работает следующим образом. После попадания в ток крови, она движется вместе с кровью, и когда она встречает агенты, которые демонстрируют наличие повреждения, она в 10 раз сильнее прилипает к стенке сосуда. Таким образом, стволовая клетка останавливается именно там, где есть повреждение.
В зоне воспаления она вырабатывает паракринные факторы (то есть оказывает действие на соседние клетки), лечит, а потом умирает. От нее практически ничего не остается.
Если стволовая клетка доходит до зоны повреждения, естественно, возникает вопрос, нельзя ли доставить вместе с ней лекарства или еще что-нибудь. В первую очередь этот вопрос возникает в отношении опухоли. Опухоль тоже распознается как повреждение, поэтому МСК приходят и в строму опухоли. В связи с этим возникла идея вставлять в МСК гены, разрушающие опухоль (а такие гены есть). Таким образом, стволовая клетка используется как средство доставки агента.
Такие эксперименты широко проводились за рубежом. Они достаточно дорогие, требуют соответствующей метки, сложной аппаратуры для наблюдений. В силу данных причин, к сожалению, в России эти опыты проводились мало.
Наноалмазы
В качестве средств доставки лекарств и генов также используются наноалмазы. Наноалмазы из организма уходят достаточно медленно, они попадают к нам не только в кровь, но и в лимфу, тканевую жидкость, а уходят с потом, мочой и калом. Но зато алмаз химически инертен, то есть мы не вносим в организм никакой химии. Поскольку алмаз – это очень маленькая механическая частичка, то он не наносит нам вреда ни с механических, ни с химических позиций. Зато он сможет доставить нам нужные лекарства. Наноалмазы попадают в зону, где находятся взрослые стволовые клетки, при этом даже без всяких лекарств они активируют кроветворную систему.
Это лишь первые эксперименты, но если мы пойдем по этому пути, то мы сможем продукты МСК применять вместо клеток. Культуры клеток, естественно, надо выращивать, хранить, это очень трудоемкий процесс. А вот их продукты будут получаться заодно.
Наноалмазы совместно со стволовыми клетками и их продуктами – очень перспективная возможность снабжения генами, лекарствами проблемных тканей и органов. В этом вопросе еще много неизвестного. Но это направление может получить очень бурное развитие, таким образом, могут быть созданы новые способы лечения, безопасные и эффективные – то, что и требуется от лекарств. В этом отношении стволовые клетки признаются надеждой фармакологии современности.
Тканевая инженерия
Тканевая инженерия - самая молодая, но, несомненно, очень перспективная отрасль медицины. Ее задачей является создание новых материалов для реставрации/замены поврежденных тканей или даже органов.
Тканевая инженерия – нацелена на создание биологических заместителей тканей и органов.
Тканевая инженерия базируется на междисциплинарном подходе. При этом новейшие испытания в сфере стволовых клеток открывают новое будущее для развития этого направления. Стволовые клетки могут использоваться для выращивания из них тканей.
Самым первым направлением в тканевой инженерии было создание эквивалентов кожи. Ведь часто требуется восстановление довольно больших участков кожи после травм, ожогов. Обычно у больного берут кожу в других местах и пересаживают на поврежденный участок. А можно взять МСК этого человека, сделать некий каркас, посадить на него клетки и прикрыть им поврежденную часть. Таким образом, создается полученная искусственным путем кожа. При этом кожа будет не искусственной, а настоящей!
Живые равнозначные фрагменты кожи, в составе которых присутствуют донорские или собственные кожные клетки, в настоящее время широко применяются в США, России, Италии. Эти системы улучшают заживление поверхностей пораженных ожогами. В России этим направлением активно занимаются некоторые клиники в сотрудничестве с НИИ им. Н.В. Склифософского, Федеральный медицинский биофизический центр им. Бурназяна и др.
Разработка графтов ведется в различных направлениях медицины: кардиология (искусственные клапаны сердца, реконструкция крупных сосудов и капиллярных сетей); восстановление органов дыхания (гортань, трахея и бронхи), тонкого кишечника, печени, органов мочевыделительной системы, желез внутренней секреции и нейронов.
Стволовые клетки нашли широкое применение в области тканевой инженерии. Некоторые ученые считают возможным использовать наночастицы металлов для контроля роста клеток, влияя на них магнитными полями разной направленности. Например, таким образом удалось создать такие сложные структуры, как элементы сетчатки глаза.
Создание искусственных тканей и органов позволит улучшить качество жизни, увеличит выживаемость пациентов и даст возможность отказаться от трансплантации донорских органов.
Больших успехов в этой области добилась группа ученых под руководством проф. Энтони Атала в США. За прошедшие десять лет профессору Энтони Атале удалось вырастить и трансплантировать людям несколько десятков мочевых пузырей. Сегодня в лаборатории Аталы выращивают более двух десятков типов тканей – от сердечных клапанов и кровеносных сосудов до мышц пальцев. Перспективной биоинженерной технологией является выращивание из стволовых клеток полноценных коренных зубов. Год от года в этом направлении появляются все новые достижения. Зубы, выращенные при помощи стволовых клеток значительно более органично встраиваются в зубочелюстную систему и не вызывают физического и психологического отторжения. Как показывают предварительные расчеты, стоимость подобного протезирования не будет значительно превышать стоимость обычного искусственного протезирования. Эксперты считают, в перспективе, данная технология будет использоваться в стоматологии лет через 5. Но и этот прогноз, согласитесь, внушает немало надежд! Эта идея затрагивает интересы многих людей. Среднестатистический европеец к пятидесяти годам теряет около четверти собственных зубов.
В стоматологии стволовые клетки возможно использовать для выращивания полностью утраченного зуба, для запуска процесса самовосстановления, самореставрации частично разрушенного зуба или его элементов, для лечения пародонтоза и других заболеваниях десен. Весьма возможное и перспективное применение данной технологии – борьба с такими пороками развития зубочелюстной системы, как волчья пасть или заячья губа.
В области тканевой инженерии есть немало начинаний, которые пока кажутся фантастическими. Например, попытки вырастить в лабораторных условиях нервы, сделать мышцы, протезы органов зрения или слуховой аппарат. Работа в этом направлении интенсивно ведется в научных центрах разных стран. И возможно, многие идеи станут реальностью в ближайшие годы.
Тут можно вспомнить лозунг, который Генри Форд вывешивал на своих заводах для рабочих у поточных линий: «У нас есть запасные части для автомобилей, но помни, что Господь Бог для человека запчастей не создал. Будь осторожен!» Но теперь мы можем возразить, что хотя Господь Бог не создал для нас запчастей, но мы их создаем своим разумом, своими руками.
В последнее время во всем мире наблюдается тревожная закономерность, которая заключающееся в росте количества заболеваний и инвалидизации людей трудоспособного возраста, что настоятельно требует освоения и внедрения в клиническую практику новых, более эффективных и доступных методов восстановительного лечения больных.
Одним из таких методов наряду с имплантацией и трансплантацией является тканевая инженерия. Клеточная и тканевая инженерия - является последним достижением в области молекулярной и клеточной биологии. Этот подход открыл широкие перспективы для создания эффективных биомедицинских технологий, с помощью которых становится возможным восстановление поврежденных тканей и органов и лечение ряда тяжелых метаболических заболеваний человека.
Цель тканевой инженерии - конструирование и выращивание вне организма человека живых, функциональных тканей или органов для последующей трансплантации пациенту с целью замены или стимуляции регенерации поврежденных органа или ткани. Иными словами, на месте дефекта должна быть восстановлена трехмерная структура ткани.
Обычные имплантаты из инертных материалов могут устранить только физические и механические недостатки поврежденных тканей, - в отличие от тканей, полученных методом инженерии, которые восстанавливают, в том числе, и биологические (метаболические) функции. То есть, происходит регенерация ткани, а не простое замещение ее синтетическим материалом.
Однако для развития и совершенствования методов реконструктивной медицины на базе тканевой инженерии необходимо освоение новых высокофункциональных материалов. Эти материалы, применяемые для создания биоимплантатов, должны придавать тканеинженерным конструкциям характеристики, присущие живым тканям. Среди этих характеристик:
- 1) способность к самовосстановлению;
- 2) способность поддерживать кровоснабжение;
- 3) способность изменять строение и свойства в ответ на факторы окружающей среды, включая механическую нагрузку.
Наиболее важным элементом успеха является наличие необходимого количества функционально активных клеток, способных дифференцироваться, поддерживать соответствующий фенотип и выполнять конкретные биологические функции. Источником клеток могут быть ткани организма и внутренние органы. Возможно использование соответствующих клеток от пациента, нуждающегося в реконструктивной терапии, или от близкого родственника (аутогенных клеток). Могут быть использованы клетки различного происхождения, в том числе первичные и стволовые клетки. Первичные клетки - это зрелые клетки определенной ткани, которые могут быть взяты непосредственно от организма-донора (ex vivo) хирургическим путем. Если первичные клетки взяты у определенного организма-донора, и впоследствии необходимо имплантировать эти клетки ему же в качестве реципиента, то вероятность отторжения имплантированной ткани исключается, поскольку присутствует максимально возможная иммунологическая совместимость первичных клеток и реципиента. Однако первичные клетки, как правило, не способны делиться - их потенциал к размножению и росту низок. При культивировании таких клеток in vitro (посредством тканевой инженерии) для некоторых типов клеток возможна дедифференцировка, то есть потеря специфических, индивидуальных свойств. Так, например, хондроциты, вводимые в культуру вне организма, часто продуцируют фиброзный, а не прозрачный хрящ.
Поскольку первичные клетки не способны делиться и могут потерять свои специфичные свойства, возникла необходимость альтернативных источников клеток для развития технологий клеточной инженерии. Таковой альтернативой стали стволовые клетки.
Стволовые клетки - недифференцированные клетки, которые имеют способность к делению, самообновлению и дифференцировке в различные типы специализированных клеток под воздействием конкретных биологических стимулов.
Стволовые клетки подразделяются на "взрослые" и "эмбриональные". Эмбриональные стволовые клетки образуются из внутренней клеточной массы развития зародыша на ранней стадии, а взрослые - из тканей взрослого организма, пуповины или даже плодных тканей. Однако существует этическая проблема, связанная с неизбежным разрушением человеческого эмбриона при получении эмбриональных стволовых клеток. Поэтому предпочтительнее "добыча" клеток из тканей взрослого организма. Так, например, в 2007 году Шинью Яманакой (Shinya Yamanaka) из Киотского университета Японии были открыты индуцированные плюрипотентные стволовые клетки (ИПСК), получаемые из покровных тканей человека (в основном, из кожи). ИПСК открывают поистине невиданные возможности для регенеративной медицины, хотя, прежде чем они всерьез войдут в медицинскую практику, предстоит решить еще немало проблем.
Для направления организации, поддержания роста и дифференцировки клеток в процессе реконструкции поврежденной ткани необходим специальный носитель клеток - матрикс, представляющий из себя трехмерную сеть, похожую на губку или пемзу. Для их создания применяют биологически инертные синтетические материалы, материалы на основе природных полимеров (хитозан, альгинат, коллаген) и биокомпозиты. Так, например, эквиваленты костной ткани получают путем направленной дифференцировки стволовых клеток костного мозга, пуповинной крови или жировой ткани в остеобласты, которые затем наносят на различные материалы, поддерживающие их деление (например, донорскую кость, коллагеновые матрицы и др.).
На сегодняшний день одна из стратегий тканевой инженерии такова:
- 1) отбор и культивирование собственных или донорских стволовых клеток;
- 2) разработка специального носителя для клеток (матрицы) на основе биосовместимых материалов;
- 3) нанесение культуры клеток на матрицу и размножение клеток в биореакторе со специальными условиями культивирования;
- 4) непосредственное внедрение тканеинженерной конструкции в область пораженного органа или предварительное размещение в области, хорошо снабжаемой кровью, для дозревания и формирования микроциркуляции внутри конструкции (префабрикация).
Матриксы через некоторое время после имплантации в организм хозяина полностью исчезают (в зависимости от скорости роста ткани), а в месте дефекта останется только новая ткань. Также возможно внедрение матрикса с уже частично сформированной новой тканью ("биокомпозит"). Безусловно, после имплантации тканеинженерная конструкция должна сохранить свои структуру и функции в течение периода времени, достаточного для восстановления нормально функционирующей ткани в месте дефекта, и интегрироваться с окружающими тканями. Но, к сожалению, идеальные матриксы, удовлетворяющие всем необходимым условиям, пока не созданы.
Перспективные тканеинженерные технологии открыли возможность лабораторного создания живых тканей и органов, но перед созданием сложных органов наука пока бессильна. Однако сравнительно недавно ученые под руководством доктора Гунтера Товара (Gunter Tovar) из Общества Фраунгофера в Германии сделали огромнейший прорыв в сфере тканевой инженерии - они разработали технологию создания кровеносных сосудов. А ведь казалось, что капиллярные структуры создать искусственно невозможно, поскольку они должны быть гибкими, эластичными, малой формы и при этом взаимодействовать с естественными тканями. Как ни странно, но на помощь пришли производственные технологии - метод быстрого прототипирования (другими словами, 3D-печать). Подразумевается, что сложная трехмерная модель (в нашем случае кровеносный сосуд) печатается на трехмерном струйном принтере с использованием специальных "чернил".
Принтер наносит материал послойно, и в определенных местах слои соединяются химически. Однако заметим, что для мельчайших капилляров трехмерные принтеры пока недостаточно точны. В связи с этим был применен метод многофотонной полимеризации, используемый в полимерной промышленности. Короткие интенсивные лазерные импульсы, обрабатывающие материал, так сильно возбуждают молекулы, что они взаимодействуют друг с другом, соединяясь в длинные цепочки. Таким образом, материал полимеризуется и становится твердым, но эластичным, как естественные материалы. Эти реакции настолько управляемы, что с их помощью можно создавать мельчайшие структуры по трехмерному "чертежу".
А для того, чтобы созданные кровеносные сосуды могли состыковаться с клетками организма, при изготовлении сосудов в них интегрируют модифицированные биологические структуры (например, гепарин) и "якорные" белки. На следующем этапе в системе созданных "трубочек" закрепляются клетки эндотелия (однослойный пласт плоских клеток, выстилающий внутреннюю поверхность кровеносных сосудов) - для того, чтобы компоненты крови не приклеивались к стенкам сосудистой системы, а свободно транспортировались по ней.
Однако прежде чем действительно можно будет имплантировать выращенные в лаборатории органы с собственными кровеносными сосудами, пройдет еще какое-то время.
Осенью 2008 года руководитель клиники Университета Барселоны (Испания) и Медицинской школы Ганновера (Германия) профессор Паоло Маккиарини (Paolo Macchiarini) провел первую успешную операцию по трансплантации биоинженерного эквивалента трахеи пациентке со стенозом главного левого бронха на протяжении 3 см.
В качестве матрикса будущего трансплантата был взят сегмент трупной трахеи длиной 7 см. Чтобы получить природную матрицу, по свойствам превосходящую все то, что можно сделать из полимерных трубок, трахею очистили от окружающей соединительной ткани, клеток донора и антигенов гистосовместимости. Очищение заключалось в 25 циклах девитализации с применением 4% -деоксихолата натрия и дезоксирибонуклеазы I (процесс занял 6 недель). После каждого цикла девитализации проводили гистологическое исследование ткани для выявления количества оставшихся ядросодержащих клеток, а также иммуногистохимическое исследование на наличие в ткани антигенов гистосовместимости HLA-ABC, HLA-DR, HLA-DP и HLA-DQ. Благодаря биореактору собственной разработки ученые на поверхность медленно вращающегося отрезка трахеи равномерно нанесли шприцем суспензию клеток. Затем трансплантат, наполовину погруженный в среду для культивирования, вращался вокруг своей оси с целью попеременного контакта клеток со средой и воздухом.
В будущем, как говорят фантасты, для излечения от недуга нужно будет всего лишь зайти в аптеку, похожую на склад с запчастями. И выбрать нужную полку. Вот здесь запасные глаза, вот печень, почки, а в этом ящике руки и ноги разных размеров Не отстают от писателей и голливудские фантазеры, они тоже подливают масла в огонь этой темы: эффектно отрастающие новые руки и ноги супергероев впечатляют. Но в жизни, разумеется, все гораздо прозаичнее, нежели на экране. Хотя некоторые предпосылки к тому, чтобы в скором времени человек «примерил» биоискусственные органы, уже есть.
Тканевая инженерия активно развивающаяся отрасль медицины и биологии буквально воплощает фантастику в жизнь. Специалисты, занятые в этой области, изучая строение живых тканей, пытаются вырастить их в лабораторных условиях, чтобы затем использовать искусственно созданную ткань для трансплантации. Такое «производство» откроет очень серьезные перспективы. Стоит только вдуматься в это: заболевший (раненый, покалеченный) человек сможет быстро восстанавливаться, он получит неисчерпаемый источник для замены поврежденных органов. Ведь современные темпы урбанизации и развитие технических средств, как ни странно, подвергают жителей Земли все большим опасностям и болезням, всевозможным травмам в различных катастрофах, так что задача тканевых инженеров действительно широка вырастить кости, хрящи и органы для замены поврежденных.
Как и все разделы медицины, тканевая инженерия имеет собственную терминологию и свои методологические подходы. Любая «тканеинженерная» процедура начинается с получения исходного клеточного материала первого шага. Как правило, для этого проводят биопсию, то есть забирают у пациента, нуждающегося в биоискусственной ткани, клетки нужного типа. Однако не все клетки могут достаточно интенсивно размножаться в искусственной среде. Поэтому другой подход состоит в том, чтобы отобрать недифференцированные клетки-предшественники, так называемые стволовые клетки , которые будут созревать и специализироваться уже в лабораторных условиях. Этим определяется взаимосвязь тканевой инженерии с исследованиями стволовых клеток. Однако не следует отождествлять эти два направления биомедицинских исследований тканевые инженеры работали над своими проектами еще задолго до того, как термин «стволовые клетки» стал знаком широкой публике.
Второй шаг культивирование полученных клеток в лабораторных условиях (in vitro) с целью увеличить во много раз их количество. При этом в случае использования недифференцированных (стволовых) клеток они помещаются в специальную среду, которая индуцирует их превращение в клетки строго заданного вида. Чтобы понять, насколько это сложно, достаточно сказать, что в организме насчитывается более 200 разновидностей клеток. Для достижения нужного результата культивирование проводится в специальных биореакторах. В них не только моделируется состав газовой смеси и набор веществ в питательной среде, но и поддерживаются необходимые для развития клеток и тканей физические параметры освещенность, течение или пульсация жидкости, гравитация и т. п.
Но для выращивания живой ткани мало просто получить достаточное количество нужных клеток, необходимо, чтобы они были надлежащим образом организованы в пространстве. Поэтому следующим шагом становится формирование трехмерного каркаса носителя для искомой ткани, на котором они бы могли нормально развиваться и выполнять свои функции после пересадки в организм.
Наконец, в итоге всех этих сложных манипуляций появляется готовый биоискусственный эквивалент ткани графт, и тогда наступает последний этап его имплантация в тело пациента (графтинг). Использование собственных клеток пациента для изготовления графта основополагающий принцип тканевой инженерии. Забирая аутоклетки, врачи избегают иммунологических проблем отторжения пересаженного материала, благодаря чему шансы на удачный исход операции резко возрастают.
У истоков тканевой инженерии
Если не считать сотворения Евы из ребра Адама, то выращивание клеток и тканей началось на закате XIX века. В 1885 году немецкий эмбриолог Вильгельм Ру в течение нескольких дней смог поддерживать жизнеспособность фрагмента куриного эмбриона в искусственных условиях. Однако настоящих успехов в культивировании тканей вне организма удалось достичь только после экспериментов Р. Гаррисона в 1907 году: он предложил использовать свернувшуюся кровь или лимфу в качестве среды для развития тканей в лабораторной посуде in vitro.
В Россию этот метод пришел в 1913 году, когда сотрудник Императорской Военно-медицинской академии П.П. Авроров и его коллега А.Д. Тимофеевский смогли в течение некоторого времени выращивать клетки лейкозной крови. А годом позже этой проблемой заинтересовался великий российский гистолог Александр Александрович Максимов, профессор той же академии, который не только подтвердил данным методом унитарную теорию кроветворения, то есть доказал, что все клетки крови развиваются из общего предшественника стволовой клетки, но и заложил основу для дальнейших разработок в области культивирования тканей вне организма. На базе его результатов были выполнены сотни работ по выращиванию клеток соединительной ткани и крови, созданию тканеинженерных эквивалентов костной ткани. Его приоритет в этих исследованиях признан всемирно.
Настоящая же эра тканевой инженерии, да и собственно выделение ее как самостоятельной отрасли медицины, началась с дерзких работ К. Ваканти по совмещению в лабораторных условиях живых клеток и искусственных носителей для них, которые он предпринял в 80-х годах прошедшего столетия. На сегодня, пожалуй, не осталось ни одного человеческого органа, развитие и регенерацию которого тканевые инженеры не пытались бы «приручить».
Основа ткани
Выбор носителя для развития искусственной ткани одна из самых серьезных проблем тканевой инженерии. Его материал должен быть безопасным как для тех клеток, которые на нем будут жить, так и в целом для организма, куда потом будет пересаживаться биоискусственная ткань. В идеале материал со временем полностью замещается тканью организма. При этом он должен иметь уникальную, характерную для данного типа ткани трехмерную организацию, которая воспроизводила бы структуру межклеточного матрикса живой ткани. Например, для воссоздания полых трубчатых органов используют лишенные жизнеспособных клеток участки аналогичных органов (кишечника, трахеи, мочеточников и мочевого пузыря), полученных от крупных животных. Но в качестве таких носителей могут быть применены другие, самые разнообразные и подчас весьма неожиданные материалы.
Проще всего (если, конечно, тут вообще уместно говорить о простоте) оказалось создать биоискусственные кости. В качестве источников клеток для будущих костей используют стволовые стромальные клетки костного мозга, которые могут развиваться в клетки разных тканей, а также остеогенные (способные образовывать костную ткань) клетки иного происхождения. Настоящее поле для фантазии представляется при выборе носителя для них. В ход идут коллагены различных типов, стеклокристаллические материалы, даже кораллы. Неплохой основой служат безжизненные (трупные) кости человека и животных, а также сложные синтетические конструкции, растворяющиеся за определенный срок в организме. В последнем случае основной проблемой является синхронизация процесса остеогенеза, то есть образования костной ткани в области ее дефицита и растворения привнесенной искусственной конструкции. На сегодняшний день по всему миру выполнено уже несколько тысяч хирургических вмешательств с использованием тканеинженерных эквивалентов костной ткани.
Весьма востребована на рынке медицинских услуг клеточная и тканевая реконструкция суставного хряща. Хрящ особая ткань, которая в естественных условиях не регенерирует. По некоторым экспертным оценкам, рынок этих продуктов только в США может составлять сотни миллионов долларов в год.
Не обошли вниманием тканевые инженеры и кожу самый большой орган на теле человека. Общая площадь кожного покрова взрослого мужчины достигает 2,5 м 2 при весе 1520 кг (с учетом подкожной клетчатки). Кожа устроена достаточно сложно и выполняет ряд жизненно важных функций, вот почему при ее обширных повреждениях, помимо местных расстройств, могут наблюдаться и общие патологические проявления, подчас ставящие жизнь больного под угрозу. При сильных ожогах и длительно не заживающих язвах кожа неспособна сама восстанавливать свою целостность. На помощь приходят специалисты, у которых уже есть не только лабораторные прототипы, но и коммерческие образцы биоискусственной кожи. На сегодняшний день тысячи человек в мире уже успели воспользоваться услугами фирм, предлагающих на рынке медицинских услуг подобные тканевые препараты.Но самых фантастических результатов достигли тканевые инженеры в детской практике. Растущий организм предъявляет особые требования к созданию тканеинженерных конструкций ведь они должны расти вместе с организмом ребенка. Так, недавно немецкими учеными был создан тканеинженерный сердечный клапан. В качестве основы для клеток сосудистой стенки (эндотелия) был взят сердечный клапан взрослой свиньи. А источником клеточного материала стали клетки пуповинной крови ребенка. Между прочим, до недавнего времени пуповинную кровь при родах выбрасывали вместе с плацентой, но теперь все больше данных свидетельствует о том, что сохранение этих клеток в гемабанках в определенных случаях может дать шанс для спасения жизни человека.
Искусственная челюсть
Не так давно группа немецких специалистов из города Киль под руководством Патрика Варнке (Patrick Warnke) сообщила об успешном воссоздании нижней челюсти, которая была практически полностью удалена в связи с опухолевым поражением. Первоначально врачам пришлось создать титановый каркас челюсти, который был заполнен костным матриксом, костным мозгом пациента и факторами роста кости. Однако такой большой фрагмент не мог быть помещен сразу в область повреждения, ведь лишенные собственной сосудистой сети клетки костного мозга, в том числе и стволовые, не только бы не дифференцировались в остеобласты (клетки, продуцирующие костную ткань), но и погибли от кислородного голодания и отсутствия питательных веществ. Поэтому полученную конструкцию внедрили в мышцы спины. Это было сделано для того, чтобы в толще интенсивно снабжаемых кровью мышц сосуды сами проросли в толщу «биологического протеза». Когда это произошло, конструкцию извлекли и пересадили на должное место, предварительно соединив сосуды нижней челюсти и биопротеза микрохирургическим путем.
С каждым годом таких или подобных операций проводится все больше. Они позволяют не только восстановить функцию утраченного органа, но и обеспечить эстетический косметический эффект.
Сосуды тканям!
Одним из факторов, ограничивающих фантазию тканевых инженеров, является невозможность создания относительно больших конструкций в связи с отсутствием их адекватного кровоснабжения и иннервации (связи с центральной нервной системой). Тканеинженерные конструкции, изъятые из искусственной среды, рискуют погибнуть из-за того, что в них нет кровеносных сосудов и в теле пациента они не будут в достаточной мере снабжаться питательными веществами. Частично эту проблему можно решить методом префабрификации временного помещения созданной в лаборатории тканеинженерной конструкции под кожу или между мышц. Через некоторое время, когда сосуды прорастут весь объем графта, его выделяют с сохранением сосудов и переносят в область повреждения. Однако такой подход связан с нанесением пациенту дополнительной операционной травмы, поэтому тканевые инженеры нашли гениальное решение: биоискусственным тканям биоискусственные сосуды! Первые работы были проведены с полимерными микротрубочками, выстланными изнутри эндотелием. Такие трубочки пронизывают всю толщу созданной в лаборатории ткани. Постепенно полимер рассасывается и не мешает обмену газами и питательными веществами между кровью и клетками.
На сегодняшний день уже практически ничто не ограничивает возможностей тканевых инженеров. Созданы не только лабораторные прототипы, но и применены в клинической практике тканеинженерные эквиваленты сосков молочных желез, биоискусственный мочевой пузырь, мочеточники. Определены методические подходы к созданию легких, печени, трахеи, участков кишечника и даже кавернозных тел полового члена.
Конструирование паренхиматозных органов печени, легких и других представляет особую сложность, поскольку все клетки в них находятся в тонкой взаимосвязи и должны строго занимать надлежащее им место в трехмерном пространстве. Неожиданные положительные результаты здесь проявились при выращивании клеток во взвешенном состоянии без прикрепления к поверхности. Группа исследователей под руководством профессора Колина Макгуккина (Colin McGuckin) из Университета Ньюкасла, Великобритания, использовала вращающийся биореактор, разработанный 10 лет назад специально для Международной космической станции. Он позволяет имитировать на Земле условия невесомости и микрогравитации. Оказалось, что при культивировании в нем стволовых клеток пуповинной крови можно добиться не только их превращения в функционально активные клетки печени, но и органогенеза образования аналога печеночной ткани с присущими ей функциями.
Не менее удивительные результаты дали опыты по насыщению культуры клеток металлическими наночастицами посредством липосом, беспрепятственно проникающих через клеточную мембрану. Пребывание таких структур внутри клетки практически не оказывает на нее влияния. Зато ученые получают возможность контролировать рост клеток, воздействуя на них магнитными полями разной направленности. Таким способом удалось создать не только аналоги структур печени, но и такие сложные структуры, как элементы сетчатки глаза. Разработки тканеинженерного глаза еще находятся в самых начальных стадиях, но уже удалось получить эквиваленты отдельных его частей роговицы, склеры, радужки. Правда, проблема интеграции полученных частей пока не решена. Тем не менее в научной литературе можно встретить сведения о трансплантации светочувствительных клеток палочек и колбочек в «святая святых» глаза сетчатку, правда, пока только в экспериментальных условиях.Пожалуй, чтобы окончательно почувствовать себя всемогущими, тканевым инженерам осталось лишь научиться воссоздавать в лабораторных условиях сложные производные нервных зачатков.
В ведущих западных и отечественных лабораториях специалисты пытаются воспроизвести развитие и другого крайне трудного для восстановления органа зуба. Трудности с его созданием вызваны тем, что составляющие зуба развиваются из различных источников: часть из производных нервной системы нервного гребня, а часть из эпителиальной выстилки ротовой полости. Совместить эти источники in vitro длительное время не удавалось. На сегодняшний момент в искусственных условиях частично воспроизведены лишь ранние стадии развития зуба. Как правило, без помощи организма здесь не обойтись и после этапа лабораторной работы прообраз будущего зуба все равно приходится подсаживать в его естественное окружение альвеолу челюсти (зубную лунку) для полного «созревания» тканеинженерной конструкции.
В итоге можно сказать, что минувшее двадцатилетие ознаменовалось становлением новой отрасли биологии и медицины тканевой инженерии. Специалисты, работающие в этой области, обладают поистине уникальными качествами. Они должны быть в равной степени и врачами, и биологами, а также иметь навыки хирурга. Таковых сейчас нигде не готовят, по крайней мере, в нашей стране. Как правило, тканевые инженеры это энтузиасты, которые поставили перед собой цель претворить сказку из детства в реальность. Пока общечеловеческая проблема, которой они занимаются, далека от разрешения. Ежегодно сотни тысяч людей по всему миру погибают от хронических заболеваний, так и не дождавшись спасительной пересадки донорского органа. Сегодня, видимо, уже не найдется ученых, которые стали бы отрицать, что тканевая инженерия это медицина будущего, успехи которой имеют колоссальное значение для всего человечества. Но вместе с тем сложно найти и такого специалиста, который безоговорочно призовет всех лечиться, прибегая к методам тканевой инженерии слишком уж много вопросов и нерешенных проблем стоит перед этой очень перспективной областью знаний.
Сайты по теме
www.celltranspl.ru Сайт «Клеточные технологии в медицине». Здесь же размещается электронный журнал «Клеточная трансплантология и тканевая инженерия».
www.gemabank.ru Сайт банка стволовых клеток «Гемабанк» посвящен теме хранения и использования пуповинной крови.
organprint.missouri.edu Сайт научной группы из Университета штата Миссури, США, посвященный напечатанным на специализированном принтере искусственным органам.
Тканевая инженерия (ТИ), как дисциплина, начала свою историю в первой половине XX века. Фундаментом для её основания послужили теоретические и практические разработки по созданию "искусственных" органов и тканей и работы по трансплантации клеток и биологически активных компонентов на носителях для восстановления повреждений в различных тканях организма (Langer R., Vacanti J.P., 1993).
В настоящее время, тканевая инженерия является одной из наиболее молодых отраслей в медицине, базирующейся на принципах молекулярной биологии и генной инженерии. Используемый в ней междисциплинарный подход направлен в первую очередь на создание новых биокомпозиционных материалов для восстановления утраченных функций отдельных тканей или органов в целом (Spector M., 1999). Основные принципы данного подхода заключаются в разработке и применении при имплантации в поврежденный орган или ткань носителей из биодеградирующих материалов, которые используются в сочетании либо с донорскими клетками и/или с биоактивными веществами. Например, при лечении раневого процесса - это могут быть коллагеновые покрытия с аллофибробластами, а в сосудистой хирургии - искусственные сосуды с антикоагулянтами (Vacanti С.А. et.al., 1993). Кроме того, одним из серьезных требований к такого рода материалам-носителям является и то, что они должны обеспечивать надежную поддерживающую, то есть опорную и/или структурообразовательную функцию в поврежденной области ткани или органа.
Следовательно, одной из основных задач тканевой инженерии в области лечения костных патологий является создание искусственных биокомпозитов, состоящих из алло- и/или ксеноматериалов в сочетании с биоактивными молекулами (костные морфогенетические белки, факторы роста и т.д.) и способных индуцировать остеогенез. При этом такие биоматериалы должны обладать рядом необходимых свойств кости (Yannas I.V. et.al., 1984; Reddi A.H.et.al., 1987; Reddi A.H., 1998).
Во-первых, они должны выполнять и поддерживать (scaffold) объем дефекта.
Во-вторых, обладать остеоидуктивностью, то есть активно побуждать остеобласты и, возможно, другие мезенхимальные клетки к формированию кости.
И, в-третьих, иметь хорошие показатели биоинтеграции и биосовместимости, то есть быть деградируемыми и не вызывать у рецепиента воспалительных и иммунных реакций. Последнее качество обычно достигается в биоматериале только за счет снижения его антигенных характеристик.
Совокупность всех этих свойств позволяет таким биоматериалам параллельно с опорной, механической функцией, обеспечивать и биоинтеграцию - врастание клеток и сосудов в структуры имплантата с последующим формированием костной ткани.
Известно, что поддерживающий эффект любого биоматериала обеспечивается, как правило, его структурными особенностями. Для биоматериалов этот показатель обычно связан с архитектоникой нативной ткани, из которой он получен. Для кости, основными параметрами её структурной прочности являются твердо-эластические характеристики костного матрикса и величина пор в нем (Marra P. G.1998; Thomson R.C. et.al., 1998).
К наиболее распространенным биоматериалам с четко выраженной опорной функцией относятся искусственный и натуральный гидроксиапатит (ГА), биокерамика, полигликолевая кислота, а также коллагеновые белки (Friess W.,1998).
В настоящее время для замещения костных дефектов в хирургической стоматологии, ортопедии и травматологии используются много различных форм гидроксиапатита, отличающихся по форме и величине частиц. Считается, что искусственно полученный гидроксиапатит, по химическому составу и кристаллографическим показателям практически идентичен гидроксиапатиту нативной кости (Parsons J., 1988). Многими авторами и экспериментально, и клинически показано, что использование гидроксиапатита имеет значительные преимущества перед другими имплантационными материалами. Так, к его положительным характеристикам относятся такие показатели как легкость стерилизации, продолжительный срок хранения, высокий уровень биосовместимости и крайне медленная резорбция в организме (Воложин А.И. и соавт., 1993). Гидроксиапатит является биоинертным и хорошо совместимым с костью материалом (Jarcho M. et.al., 1977), как было показано с помощью экспериментальных исследований. В процессе замещения костного дефекта в присутствии ГА под влиянием биологических жидкостей и тканевых ферментов гидроксиапатит может частично или полностью резорбироваться (Klein А.А.,1983). Положительный эффект гидроксиапатита после его имплантации в костную полость объясняется, по-видимому, не только остеокондуктивными свойствами материала, но и его способностью сорбировать на своей поверхности белки, индуцирующие остеогенез (Ripamonti U., Reddi A.H., 1992).
В настоящее время основную часть биоматериалов для восстановления костных дефектов получают из хрящевой и/или костной тканей человека или различных животных. Часто для изготовления композиционных материалов используются компоненты и других видов соединительной ткани - кожи, сухожилий, мозговой оболочки и т.д. (Воупе P.J., 1979; Yannas I.V. et.al., 1982; Chvapel M., 1982; Goldberg V.M. et.al., 1991; Damien C.J., Parsons J.R., 1991).
Наиболее известным из современных биоматериалов является коллаген. Его широкое применение в практической медицине связано с развитием реконструктивной хирургии и поиском новых материалов, выполняющих каркасную и пластическую функции при регенерации тканей. К основным достоинствам коллагена - как пластического биоматериала следует отнести его низкую токсичность и антигенность, высокую механическую прочность и устойчивость к тканевым протезам (Истранов Л. П., 1976). Источниками получения коллагена при изготовлении изделий для пластической хирургии служат ткани богатые этим белком - кожа, сухожилия, перикард и кость. Широкое распространение в медицинской практике получил раствор кожного коллагена, выпускаемый фирмой Collagen Corp. (Palo-Alto USA), под названиями "Zyderm" и "Zyplast". На основе этого коллагена были разработаны различные изделия медицинского назначения такие как - имплантаты, покрытия для ран, хирургические нити для ушивания раневых поверхностей и т.д.
В 70-х годах прошлого столетия были впервые получены данные о влиянии коллагеновых трансплантатов на репарацию костной ткани. При этом было установлено, что коллагеновые имплантаты способствуют пролиферации фибробластов, васкуляризации близлежащих тканей и, по-видимому, индуцируют формирование новой костной ткани с последующей ее перестройкой (Reddi A.H., 1985). В качестве быстро биодеградирующего материала коллаген был применен и в виде геля при восстановлении костных дефектов (De Balso A.M., 1976). Полученные данным автором результаты также позволили предположить, что препараты на основе коллагена способны стимулировать регенерацию костной ткани.
В это же время для замещения дефектов костной ткани были начаты исследования и по применению биокомпозиционных материалов, содержащих одновременно и коллаген, и гидроксиапатит. Так, для челюстно-лицевой хирургии и хирургической стоматологии были разработаны композиции "Alveloform" и "Bigraft", содержащие очищенный фибриллярный кожный коллаген и частицы ГА (фирма Collagen Corp., Palo Alto, USA). Данные биоматериалы были применены для восстановления альвеолярного гребня при хирургическом лечении больных с парадонтитами (Krekel G. 1981, Lemons M.M.1984, Miller E. 1992). Гистологические и ультраструктурные исследования доказали, что композиция - коллаген и ГА положительно влияет на регенерацию кости гребня, но при этом такого рода биоматериалы выполняют главным образом каркасную и проводниковую функции, то есть проявляют свои остеокондуктивные свойства (Mehlisch D.R., 1989). Позднее к аналогичным выводам пришли и многие другие исследователи и в настоящее время этой точки зрения придерживается большинство ученых (Glimcher M.J., 1987; Friess W., 1992; VaccantiC.A. et.al., 1993).
Тем не менее, по данным другой группы исследователей биокомпозиционные материалы, содержащие кожный коллаген "Ziderm" и синтетический гидроксиапатит, обладают определенными остегенными потенциями. Так, Katthagen и соавт. (1984), изучая действие материала "Коллапат", содержащего кожный коллаген типа 1 и частицы высоко дисперсного гидроксиапатита, на восстановление костных дефектов бедренной кости у кроликов, установили, что регенерация костной ткани у опытных животных протекала в 5 раз быстрее, чем в контроле. Эти экспериментальные результаты легли в основу дальнейшего применения материала "Коллапат" в клинической практике.
Общеизвестно, что наиболее подходящими для трансплантации и последующей биоинтеграции несомненно являются аутотрансплантаты, которые готовятся из собственных тканей пациента и этим полностью исключаются основные иммунологические и большинство инфекционных осложнений при последующей пересадке (Enneking W.F. et.al., 1980; Summers B.N., Eisenstein S.M.,1989; Reddi A.H., 1985; Goldberg V.M. et.al., 1991). Однако, такие материалы должны готовиться непосредственно перед трансплантацией, в противном случае клиника должна иметь костный банк для хранения такого биоматериала, что в реальности доступно только очень крупным медицинским учреждениям из-за высокой стоимости приготовления и хранения данных материалов. Кроме того, возможности получения значительных количеств аутоматериала весьма ограничены и при его заборе, как правило, донор подвергается серьезным оперативным вмешательствам. Все это существенно ограничивает широкое применение аутотрансплантатов (Bos G.D. et.al., 1983; Horowitz M.C. 1991). Следовательно, в области лечения костных патологий перед тканевой инженерией стоит реальная задача по созданию биокомпозиционных материалов, применение которых обеспечит решение многих проблем как по трансплантации клеток и стимуляции формирования кости в местах ее повреждения, так и по снижению трудовых и финансовых затрат при устранении костных повреждений у больных различного профиля.
В настоящее время усилиями ряда исследователей, работающих в области тканевой инженерии, были разработаны и внедрены биокомпозиционые материалы, в состав которых входят как нативные клетки костного мозга, так и стромальные остеогенные клетки-предшественнники, выращенные в монослойных культурах костного мозга (Gupta D., 1982; Bolder S., 1998). Этими авторами было установлено, что для успешной индукции остеогенеза в месте трансплантации необходимо создать высокую, начальную плотность стромальных предшественников - порядка 108 клеток. При этом простое введение суспензии таких клеток не давало хороших результатов. В связи с этим возникла серьезная проблема поиска носителей для трансплантации клеток в организм реципиента.
Впервые в качестве такого носителя Gupta D. et. al. (1982) предложили использовать ксенокость, предварительно обезжиренную и декальцинированную. Далее было установлено, что в зависимости от степени очистки ксенокости процент прикрепления клеточных элементов к носителю увеличивается, и клетки значительно лучше связываются с органической его частью, чем с природным костным гидроксиапатитом (Hofman S., 1999).
Из синтетических материалов в качестве носителей для трансплантации клеток в настоящее время широко применяют керамику (Burder S. 1998), которая представляет из себя искусственный гидроксиапатит, полученный при обработке три-кальций фосфата высокими температурами.
Отечественные стоматологи-хирурги в качестве подходящего носителя для трансплантации аллогенных фибробластов использовали твердую мозговую оболочку и отметили, что применение данного трансплантата с аллофибробластами при лечении хронического генерализованного пародонтита средней и тяжелой степени имеет ряд преимуществ перед другими способами лечения (Дмитриева Л.А., 2001).
Ранее в серии работ по конструированию "искусственной кожи" было обнаружено, что успех восстановления данной ткани после её повреждения зависит от состояния клеточного микроокружения в поврежденном участке. С другой стороны, само микроокружение создается оптимальным сочетанием основных компонентов межклеточного матрикса, таких как коллагены, гликопротеины и протеогликаны (Yannas I. et.al., 1980, 1984; Pruitt В., Levine N., 1984; Madden M. et.al., 1994).
Коллаген является типичным фибриллярным белком. Его индивидуальная молекула - тропоколлаген состоит из трех спирализованных полипептидных цепей, называемых a-цепями, которые скручены между собой в одну общую спираль и стабилизированны водородными связями. Каждая a-цепь содержит в среднем около 1000 аминокислотных остатков. В костной ткани существует две основных комбинации цепей - две λ1 и одна λ2 или коллаген типа 1 и три λ-1 или коллаген типа III. Кроме названных типов в кости были обнаружены в минорных количествах и другие изоформы коллагена (Серов В. П., Шехтер А. Б., 1981).
Протеогликаны это сложные соединения полисахаридов с белком. Полисахариды, входящие в состав протеогликанов, представляют из себя линейные полимеры, построенные из разных дисахаридных субъединиц, образованных уроновыми кислотами (глюкуроновой, галактуроновой и идуроновой), N-ацетилгексозаминами (IM-ацетилглюкозамин, N-ацетил-галактозамин) и нейтральными сахаридами (галактозой, маннозой и ксилозой). Эти полисахаридные цепи называются гликозаминогликанами. По меньшей мере один из Сахаров в дисахариде имеет отрицательно заряженную карбоксильную или сульфатную группу (Стейси М., Баркер С,1965). Зрелая костная ткань содержит в основном сульфатированные гликозаминогликаны (сГАГ), такие как хондроитин-4- и хондроитин-6-сульфаты, дерматан-сульфат и кератан-сульфат. Биосинтез протеогликанов в костной ткани осуществляется главным образом активироваными остеобластами и в незначительной степени зрелыми остеоцитами (Juliano R., Haskell S., 1993; Wendel M., Sommarin Y., 1998).
Функциональное значение сульфатированных гликозаминогликанов в соединительной ткани (СТ) велико и связано в первую очередь с формированием коллагеновых и эластиновых волокон. Сульфатированные гликозаминогликаны участвуют практически во всех процессах обмена соединительной ткани и могут оказывать модулирующее влияние на дифференцировку её клеточных элементов (Панасюк А.Ф. и соавт., 2000). От их качественных и количественных характеристик в тканях, а также специфики взаимодействия с другими компонентами межклеточного матрикса, зависят многие показатели регенерации СТ.
Регенерация и восстановление костной ткани представляют из себя комплекс последовательных процессов, включающих как активацию клеток остеогенного ряда (рекрутирование, пролиферацию и дифференцировку), так и непосредственное формирование специализированного матрикса - его минерализацию и последующее ремоделирование костной ткани. При этом данные клетки всегда находятся под контролем и влиянием ряда биологических и механических факторов .
По современным представлениям тканевая инженерия (ТИ) костной ткани опирается на три основных принципа, обеспечивающих успешное замещение данной ткани.
Во-первых, наиболее важным принципом при создании биоматериалов и конструкций для имплантации является воспроизведение основных характеристик природного костного матрикса, потому что именно уникальное cтроение костной ткани оказывает самое выраженное влияние на процессы регенерации. Известно, что эти характеристики матрикса зависят от его трехмерной структуры и химического состава, а также от его механических свойств и способности влиять на клеточные формы соединительной ткани (СТ).
Архитектоника матрикса включает в себя такие параметры как соотношение поверхности к объему, наличие системы пор, и, что наиболее важно, его функциональные и механические свойства. Благодаря этим показателям матрикс, по-видимому, может регулировать врастание сосудов, обеспечивать хемотактические стимулы для эндогенных клеток, модулировать клеточное прикрепление, стимулировать деление, дифференцировку и последующую минерализацию. Считается, что трехмерная структура построения матрикса может влиять не только на процессы индукции, но и на саму скорость регенерации .
Следовательно, конструируемый с помощью тканевой инженерии биоматериал или конструкция должны обладать свойствами, которые в условиях in vivo способны обеспечивать как кондуктивные, так и индуктивные свойства природного матрикса. К первым относятся такие показатели как способность заполнения и поддержания объема, механическая интеграция, обеспечение проницаемости для клеток и сосудов. Вторые - обеспечивают прямое или опосредованное воздействие на клеточные формы, стимулируя их к формированию хрящевой и/или костной тканям.
Следующим важным принципом успеха направленной костной тканевой инженерии является применение экзогенных и/или активация эндогенных клеток, которые непосредственно участвуют в процессах созидания данной ткани. При этом источником таких клеток может быть как собственный, так и донорский организм. Например, использование определенных клеточных типов от плюрепотентных стромальных клеток костного мозга до коммитированных остеобластоподобных клеток были успешно использованы и в экспериментах на животных, и в клинике .
Как правило, при обратной трансплантации в организм стромальные клетки-предшественники способны дифференцироваться в зрелые формы, синтезировать матрикс и запускать каскад эндогенных реакций репарации костной ткани. Вместе с тем, альтернативный взгляд на применение композиционных биоматериалов предполагает их непосредственное воздействие на эндогенные костные и другие клетки соединительной ткани, их рекрутирование (привлечение) в зону имплантации, стимуляцию их пролиферации и повышение их биосинтетической активности, принуждая эти клетки активно формировать костную ткань. Кроме того, такие материалы могут быть хорошими клеточными носителями, на которых возможно выращивание стволовых клеток перед их трансплантацией. Последним из главных принципов успеха тканевой инженерии кости является применение биоактивных молекул, включающих факторы роста, цитокины, гормоны и другие биологически активные вещества.
Для индукции костеообразования наиболее известными факторами являются костные морфогенетические белки, трансформирующий фактор роста - TGF-β , инсулиноподобный фактор роста IGF и фактор роста эндотелия сосудов VEGF.. Следовательно, биокомпозиционный материал может быть насыщен и/или содержать в своей структуре данные биоактивные молекулы, что позволяет использовать его при имплантации в качестве депо для таких субстанций. Постепенное высвобождение данных факторов может активно влиять на процессы костного восстановления. Кроме данных веществ в состав композиционных материалов могут входить микро- и макроэлементы, а также другие молекулы (сахара, пептиды, липиды и т.д.), способные обеспечивать стимуляцию и поддержание повышенной физиологической активности клеток в восстанавливающейся костной ткани.
В настоящее время существует большое количество разнообразных биопластических материалов, которые обладают остеокондуктивными и/или остеоиндуктивными свойствами . Так, материалы, содержащие практически чистый гидроксиапатит (ГА), такие как "Остеогаф", "Био-Осс", "Остеомин", "Остим" проявляют главным образом кондуктивные свойства, хотя они и способны оказывать слабый остеоиндуктивный эффект. Другая группа материалов представляет из себя полностью или частично деминерализованную костную ткань, а так же сочетаниями этих материалов с биологически активными субстанциями, такими как костные морфогенетические белки и/или факторами роста [Панасюк А.Ф. и соавт, 2004].
Наиболее важными требованиями к биопластическим материалам остаются такие параметры, как их антигенные и индуктивные свойства. Кроме того, для разного рода операций часто требуются материалы, обладающие, наряду с вышеуказанными показателями, хорошими пластическими или прочностными характеристиками для создания и поддержания необходимых форм и конфигураций при заполнении полостей и тканевых дефектов.
С учетом всего сказанного выше, фирмой ООО "Конектбиофарм" была разработана технология получения костного коллагена и костных сульфатированных гликозаминогликанов (сГАГ) и на их основе изготовлены биокомпозиционные остеопластические материалы серий "Биоматрикс" и "Остеоматрикс". Основное различие между этими группами биоматериалов состоит в том, что "Биоматрикс" содержит костный коллаген и костные сульфатированные гликозаминогликаны, а "Остеоматрикс", имея в своем составе те же два основных компонента костной ткани, содержит ещё и гидроксиапатит в природной форме [Панасюк А.Ф. и соавт, 2004]. Источником этих биоматериалов являются губчатые и кортикальные кости различных животных, а также человека. Полученный по данной технологии костный коллаген не содержит других белков и, в условиях in vitro, практически не растворим в достаточно концентрированных растворах щелочей и органических кислот.
Это свойство позволяет биоматериалам быть не только инертными в отношении иммунной системы организма, но и в течение длительного времени после их имплантации быть устойчивым к биораспаду. В настоящее время для ускорения роста кости и мягких тканей активно применяется методика стимуляции клеток богатой тромбоцитами плазмой (БоТП). Эта новая биотехнология направленной тканевой инженерии и клеточной терапии является по мнению ряда авторов настоящим прорывом в хирургической практике . Однако, для получения такой плазмы требуется определенное техническое оснащение, а в ряде случаев и специально подготовленные сотрудники . Использование для этих целей материала "Биоматрикс" полностью решает настоящую проблему с минимальными затратами потому, что нет необходимости выделять тромбоциты из крови пациента. В серии экспериментов нами было установлено, что материал "Биоматрикс" способен специфически и в больших количествах связывать тромбоциты периферической крови (табл.1).
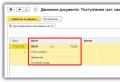
Таблица 1. Связывание тромбоцитов крови костным коллагеном.

* - 6 мл крови инкубировали с 1 гр костного коллагена (1 гр. сухого костного коллагена занимает объем от 2 до 7 см³ в зависимости от величины его пористости). Данные в таблице представлены как содержание тромбоцитов в 1 мл крови после её пропускания через 1 см³ костного коллагена.
Так, 1 см³ биоматериала "Биоматрикс" способен связывать практически все тромбоциты (более 90%) из 1 мл крови, то есть от 226 до 304 миллионов тромбоцитов. При этом связывание тромбоцитов костным коллагеном происходит быстро и завершается в течение нескольких минут (график 1).
График 1. Скорость связывания тромбоцитов крови костным коллагеном.

Было установлено также, что, если биоматериал "Биоматрикс" применялся без прикрытия антикоагулянтами, то формирование сгустка происходило практически мгновенно. В настоящее время доказано, что рабочая концентрация для богатой тромбоцитами плазмы начинается с 1 миллиона тромбоцитов в мкл..Следовательно, для получения богатой тромбоцитами плазмой тромбоциты крови необходимо сконцентрировать в среднем в 5 раз, но при этом такое выделение требует и существенных финансовых затрат, и определенного профессионального опыта. Кроме того, для активации тромбоцитов и выделения ими 7 факторов роста: 3-х видов PDGF-aa, -bb, -ab, двух трансформирующих факторов роста - TGF-β1 и β2 , фактора роста эндотелия сосудов VEGF и фактора роста эпителия EGF - богатая тромбоцитами плазма перед её употреблением должна быть коагулирована . По сравнению с известными методами, на биоматериале "Биоматрикс" удается существенно повысить концентрирование тромбоцитов. Одновременно с этим коллаген является именно тем белком, который способен активировать фактор Хагемана (ХII фактор свертывания крови) и систему комплемента.
Известно, что активированный фактор Хагемана запускает каскад реакций системы свертывания крови и приводит к образованию сгустка фибрина. Данный фактор или его фрагменты способны инициировать также калликреин-кининовую систему крови. Таким образом, костный коллаген в составе материалов "Биоматрикс" и "Остеоматрикс" способен активировать основные системы протеолиза плазмы крови, которые ответственны за поддержание гемодинамического равновесия и обеспечение регенераторных реакций организма. В отличие от богатой тромбоцитами плазмой, которая сама не обладает остеоиндуктивным эффектом, то есть не может инициировать образование кости без присутствия костных клеток, материалы "Биоматрикс" и "Остеоматрикс" обладают такой потенцией.
Так, при внутримышечной имплантации биоматериалов "Биоматрикс" и, особенно, "Остеоматрикс" происходит формирование эктопическое костной ткани, что непосредственно доказывает остеоиндуктивную активность данных материалов [Иванов С.Ю. и соавт., 2000]. Совместное применение богатой тромбоцитами плазмы с рекомбинантным костным морфогенетическим белком, который может стимулировать клетки соединительной ткани к формированию костной ткани, решает данную проблему, но это приводит к существенному удорожанию методики. Необходимо отметить также, что материалы серии "Остеоматрикс" имеют в своем составе природный костный гидроксиапатит, который способен аффинно аккумулировать на своей поверхности синтезируемые остеобластами костные морфогенетические белки, и таким образом дополнительно стимулировать остеогенез ("наведенная остеоиндукция").
При этом полностью снимается возражение о возможности развития опухолей вследствии использования рекомбинантных белков потому, что в случае аналогичного применения материалов "Биоматрикс" и "Остеоматрикс" в зоне имплантации присутствуют только естественные белки природного происхождения. Материалы серий "Биоматрикс" и "Остеоматрикс" обладают и другим уникальным качеством – они способны аффинно связывать сульфатированные гликозаминогликаны [Панасюк А.Ф., Саващук Д.А., 2007]. Это связывание в условиях подобно связыванию тромбоцитов происходит за короткий промежуток времени и количество связавшихся сульфатированных гликозаминогликанов значительно превышает физиологические показатели (таблица 2).
Таблица 2. Связывание сульфатированных гликозаминогликанов костным коллагеном.

В настоящее время хорошо известно, что применяемые по отдельности и коллаген, и гидроксиапатит обладают в основном остеокондуктивными свойствами, то есть способны играть роль только «способствующего» материала для создания новой кости. Однако, эти молекулы могут оказывать на клетки остеобластического ряда и слабый остеоиндуктивный эффект, за счет некоторых своих биологических свойств.
Этот остеоиндуктивный эффект усиливается при комплексном применении этих двух типов молекул . С другой стороны, если вместе с коллагеном и гидроксиапатитом в биоматериалах будут представлены и сульфатированные гликозаминогликаны, то такой комплекс по своей структуре будет более близок к природному костному матриксу и, следовательно, обладать его функциональными характеристиками в более полном объеме. Так, известно, что сульфатированные гликозаминогликаны оказывают влияние на многие показатели обмена соединительной ткани.
Они способны снижать активность протеолитических ферментов, подавлять синергическое действие на межклеточный матрикс данных ферментов и кислородных радикалов, блокировать синтез медиаторов воспаления за счет маскировки антигенных детерминант и отмены хемотаксиса, предотвращать апоптоз клеток, индуцированный повреждающими факторами, а также снижать синтез липидов и с помощью этого препятствовать процессам деградации. Кроме того, эти соединения принимают непосредственное участие в построении самих коллагеновых волокон и межклеточного матрикса в целом.
На ранних этапах повреждения соединительной ткани они выступают как инициаторы создания временного матрикса и позволяют преостановить распад соединительной ткани и формирование грубого рубца, а в последствии обеспечить и более быстрое его замещение на обычную для данного органа соединительную ткань [Панасюк А.Ф. и соавт, 2000]. К сожалению, роль сульфатированных гликозаминогликанов в регуляции остеогенеза изучена недостаточно, однако, показано, что основным претендентом на роль индуктора эктопического остеогенеза в модельной системе является протеогликан, секретируемый клетками эпителием мочего пузыря [Фриденштейн А.Я., Лалыкина К.С., 1972].
Аналогичного мнения придерживаются и другие авторы , считая, что протеогликаны являются одним из факторов стромального микроокружения, регулирующим гемопоэз и другие гистогенезы производных мезенхимы. Кроме того, показано, что в условиях in vitro и in vivo хондроитин-сульфаты оказывают выраженное влияние на минерализацию кости Так, нами было выявлено, что при воздействии материала "Остеоматрикс" на культуру хондроцитов человека происходит индукция их хондрогенных свойств. Под влиянием материала хондроциты человека формировали в культуре гистотипические структуры, в которых зго за отложение фосфатов и минерализацию костного матрикса в процессе его оссификации.
Далее, было установлено, что после имплантации кроликам биоматериалов "Биоматрикс", "Алломатрикс-имплант" и "Остеоматрикс" происходит формирование эктопической кости с последующим заселением её костным мозгом. Кроме того, данные материалы были успешно применены и в качестве носителей при трансплантации стволовых стромальных клеток-предшественников [Иванов С.Ю. и соавт., 2000]. К настоящему времени эти материалы завоевали признание как в стоматологической, так и в ортопедической практике [Иванов С.Ю. и соавт., 2000, Лекишвили М.В. и соавт., 2002, Грудянов А.И. и соавт., 2003, Аснина С.А. и соавт., 2004, Васильев М. Г. и соавт., 2006]. С высокой эффективностью они были применены в случаях несовершенного остеогенеза, восстановлении кисти, при хирургическом лечении заболеваний пародонта и устранении дефектов челюстных костей. Эти биоматериалы, благодаря разработанной технологии их изготовления, являются пока единственными во всем мире материалами, у которых практически полностью сохранена коллагеновая и минеральная структуры природной кости, но при этом данные материалы полностью лишены антигенности.
Большим достоинством этих биоматериалов является и то, что они содержат костные сульфатированные гликозаминогликаны, аффинно связанные с коллагеном и гидроксиапатитом, что существенно отличает их от имеющихся в мире аналогов и значительно усиливает их остеогенные потенции. Таким образом, приведенные экспериментальные и клинические данные реально доказывают, что базируясь на современных принципах тканевой инженерии были разработаны и внедрены в клиническую практику отечественные биокомпозиционные материалы на основе костных коллагена, сульфатированных гликозаминогликанов и гидроксиапатита. Эти современные, эффективные и безопасные биоматериалы нового поколения открывают широкие перспективы к решению многих проблем восстановления костной ткани в травматологии и ортопедии, а также во многих других областях хирургической практики.
На электоннограмме (рис.1) видно, что препараты костного коллагена представляют из себя сеть упорядоченно расположенных пучков и волокон. При этом сами волокна плотно упакованы в пучки второго порядка, без разрывов и дефектов. По своему виду материал имеет классическую пористо-ячеистую структуру, которая полностью соответствует архитектонике нативной губчатой кости и свободна от сосудов, белков, механических и иных включений. Размер пор колеблется от 220 до 700 мкм.
Биосовместимость костного коллагена была оценена нами по стандартным тестам в условиях имплантации их под кожу крысам породы Вистар. С помощью гисто-морфологического анализа и сканирущей электронной микроскопии было установлено, что костный коллаген после полуторамесячного пребывания в организме рецепиента практически не подвергается разрушению и сохраняет свою структуру.


Рис 1. Рис 2.
Как видно на рис.2, поры, трабекулы и ячейки имплантированного костного коллагена частично заполняются рыхлой волокнистой СТ, волокна которой слабо спаяны с имплантатом. Хорошо видно, что вокруг него формируется незначительный фиброзный слой, а в самом имплантате отмечается присутствие небольшого количества клеточных элементов, основными из которых являются фибробласты. Характерно, что имплантат практически на всем своем протяжении не спаян с окружающей тканью дермы. Эти результаты однозначно свидетельствуют о высокой устойчивости данного материала к биораспаду и о полной биоинертности в отношении него окружающей соединительной ткани.
Исследования по влиянию биоматериалов "Биоматрикс", "Алломатрикс-имплант" и "Остеоматрикс" на остеорепарацию мы провели на модели сегментарной остеотомии по общепринятым методикам (Katthagen B.D., Mittelmeeir H., 1984; Schwarz N. et.al.,1991). В эксперименте были использованы кролики породы Шиншилла массой 1,5-2,0 кг, которым под внутривенным наркозом делали сегментарную остеотомию лучевой кости.
Через два месяца после операции в зоне имплантации было отмечено формирование новой костной ткани. На рис. 3 результат гистоморфологического исследования материала "Алломатрикс-имплант" через 2 мес. после операции. В проксимальной зоне дефекта видна хорошо развитая молодая костная ткань. Остеобласты прилежат к костным балкам в большом числе.
В межуточном веществе обнаруживаются остециты в лакунах, В новом костном веществе формируются плотно упакованные коллагеновые волокна. Хорошо развито межуточное вещество с активными клетками. Зона имплантата (сверху и слева) активно перестраивается.
В общем, идет ускоренное созревание костной ткани вокруг зоны имплантата.
Кроме того, оказалось, что пористо-ячеистая структура костного коллагена обеспечивает не только поддержание объема в дефекте за счет своих упруго-эластических качеств, но и оптимальную возможность для врастания в него клеток соединительной ткани, развития сосудов и формирования кости при замещении этого дефекта.