Cancellazione di medicinali. Contabilità di medicinali, alcol, pellicole radiografiche e reagenti chimici nelle istituzioni sanitarie
L'account 233 "Medicinali e medicazioni" comprende medicinali, componenti, preparati battericidi, sieri, vaccini, sangue e medicazioni in ospedali, istituzioni mediche e preventive, mediche e veterinarie e di altro tipo, le cui stime prevedono stanziamenti con il codice +1132 "Medicinali e condimenti." Questo sottoconto tiene conto anche dei materiali ausiliari e farmaceutici nelle istituzioni mediche che hanno le proprie farmacie.
I medicinali sono in custodia di soggetti con i quali sono stati conclusi accordi di piena responsabilità.
I medicinali vengono consegnati al magazzino dai fornitori in base ai contratti stipulati con i fornitori e sono accompagnati da capitolati, fatture e fatture da segnalare al farmacista o ad altro soggetto finanziariamente responsabile nominato per ordine del responsabile dell'istituto (questo può essere il responsabile infermiera). Sulla base di questi documenti, i medicinali sono contabilizzati dalle persone indicate.
Come parte del libro azionario viene mantenuta la contabilità quantitativa soggetto. Allo stesso tempo, tutti i dati per i medicinali vengono inseriti nel libro di magazzino: nome completo, dosaggio, fa-vaniya e quantità.
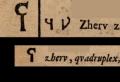
Sulla base delle specifiche e delle lettere di vettura, i medicinali sono registrati dell'adempimento degli obblighi contrattuali con i fornitori nel modulo n. 6-MZ all'arrivo dei medicinali e sono registrati da un farmacista.
I medicinali vengono rilasciati dal magazzino alle unità strutturali in base al numero effettivo di pazienti sulla base degli ordini-requisiti nel modulo n. 434. Questi documenti sono redatti in 2 copie e approvati dal capo dell'istituzione. L'ordine-requisito è firmato dal capo dell'istituto o dal dirigente medico, dal capo reparto, dalla caposala, dalla caposala dell'unità.
I medicinali ottenuti dalla composizione sono conservati nei reparti sul conto della caposala per tipo in armadietti speciali, narcotici - in casseforti, deperibili - in frigoriferi.
Per tenere conto dei medicinali ricevuti, la caposala del dipartimento conserva il Libro della contabilità quantitativa, modulo n. 8-MZ, dove registra la ricezione dei medicinali. Indica il nome dei medicinali, il dosaggio, la confezione e la quantità. In un giornale separato di forma arbitraria, vengono conservati i registri dei medicinali rivendicati ed emessi, in cui vengono registrati il nome del medicinale, l'unità di misura, il numero di farmaci richiesti e dispensati.
Per soddisfare costantemente le esigenze del reparto nei farmaci necessari, gli infermieri che lavorano presso il posto medico del reparto, nelle loro sale di manipolazione, nello spogliatoio, in sala operatoria, selezionano i farmaci che non sono sufficienti per il lavoro ed effettuano un ordine- requisito a nome della caposala del reparto.
In base a questi ordini-requisiti, la caposala del dipartimento rilascia i medicinali e li trascrive contestualmente nel giornale dei medicinali dispensati.
Nelle suddivisioni strutturali, i farmaci sono rappresentati dai seguenti gruppi:
Gruppo generale;
medicinali velenosi;
droghe;
etanolo;
Farmaci e medicazioni costosi.
Sulla base degli ordini-fabbisogni giornalieri, viene sintetizzato un prospetto delle spese quantitative dei medicinali. Le caposala dei reparti presentano all'ufficio contabilità all'inizio del mese la “Relazione sul consumo di medicinali” in termini quantitativi, a cui si aggiungono i requisiti-ordine. Questo rapporto è la base per cancellare i medicinali esauriti dal conto della persona finanziariamente responsabile.
La caposala presenta mensilmente al dipartimento di contabilità un rapporto sulla circolazione dei medicinali nel modulo n. 2-MZ. Questa relazione è approvata dal capo dell'istituzione. Il commercialista controlla questo rapporto e confronta i suoi dati con i dati dei rapporti del caposala sul trasferimento dei medicinali dal magazzino ai reparti. Sulla base delle relazioni presentate e dei documenti di accompagnamento, i medicinali ricevuti dai fornitori sono contabilizzati nell'ufficio contabilità come aiuti umanitari.
Dopo aver elaborato le relazioni dei caposala dei dipartimenti, il contabile inserisce tutti i dati sulla spesa dei farmaci nei dipartimenti fino alla spesa totale dell'istituto. L'ufficio contabilità redige un foglio di fatturato (modulo n. 296), in cui i saldi dei medicinali sono annotati per nome, quantità, prezzo e importo.
Per controllare i farmaci viene effettuata la riconciliazione mensile delle registrazioni contabili e di magazzino. Inoltre, il loro inventario viene effettuato due volte l'anno.
Un gruppo speciale di medicinali sono gli stupefacenti. La procedura per la loro conservazione e utilizzo è regolata dalla "Procedura per la circolazione di stupefacenti, sostanze psicotrope e precursori nelle istituzioni sanitarie statali e municipali dell'Ucraina", approvata con ordinanza del Ministero della Salute dell'Ucraina del 18.12. 1997 n. 356.
I medicinali appartenenti a questo gruppo sono stabiliti dall'"Elenco degli stupefacenti, delle sostanze psicotrope, dei loro analoghi e precursori soggetti a un controllo speciale in conformità con la legislazione dell'Ucraina", approvato con ordinanza del Comitato per il controllo della droga sotto il Ministero della Salute dell'Ucraina del 23 marzo 1998 n. 7.
Gli stupefacenti possono essere utilizzati dalle istituzioni sanitarie munite di apposita licenza, rilasciata dal Servizio statale per i medicinali e i medicinali di concerto con il Ministero dell'interno.
Dai magazzini delle farmacie, gli stupefacenti vengono dispensati solo per scopi medici alle istituzioni sanitarie statali e municipali con letti d'ospedale. L'elenco di tali istituzioni è approvato dall'ordine del capo del dipartimento sanitario regionale (città).
La procedura per ricevere e dispensare farmaci narcotici e psicotropi da parte di dipartimenti, uffici, posti di farmacie di queste istituzioni in una particolare istituzione medica è determinata dall'ordine del primario.
In tutte le istituzioni mediche, i loro reparti, ambulatori, FAP, centri sanitari, unità mediche, ecc., dove è consentito conservare e utilizzare stupefacenti, la loro registrazione soggetto-quantitativa viene effettuata in speciali riviste (libri) del modulo stabilito dall'ordinanza n. 356. Questi giornali (libri) devono essere numerati, rilegati e certificati:
Nelle strutture sanitarie - con sigillo tondo e firma del primario;
Negli ambulatori, negli ospedali distrettuali, nei FAP e nei punti sanitari - la firma del capo con il sigillo della struttura sanitaria di massima subordinazione;
Sui posti: la firma del capo del dipartimento a cui appartiene questo posto e il sigillo dell'istituto medico.
L'uso di stupefacenti e psicotropi viene rilasciato immediatamente dopo la fornitura di cure mediche al paziente. Le fiale usate dei fondi indicati devono essere consegnate giornalmente, esclusi i fine settimana e i giorni festivi, dalle persone responsabili della loro conservazione alla commissione per la distruzione delle fiale vuote.
La distruzione delle fiale vuote viene eseguita almeno una volta ogni 10 giorni. Dopodiché, un atto deve essere immediatamente redatto e firmato da tutti i membri della commissione secondo il modulo n. 12 stabilito dall'ordinanza n. 356.
Una commissione per la distruzione delle fiale vuote, composta da almeno 3 persone, viene creata su ordine del primario della struttura medica. È diretto dal vice capo medico per il lavoro medico e, negli istituti in cui tale posizione non è approvata, dal medico capo.
Gli stupefacenti inutilizzati rimasti presso l'operatore sanitario sembrano il responsabile della struttura sanitaria secondo l'atto di trasferimento.
Tipici conti di corrispondenza per la registrazione delle transazioni con i medicinali sono mostrati nella Tabella 45.
Tabella 45
Corrispondenza sul ricevimento e smaltimento dei medicinali
Il principale documento normativo che regola la contabilità dei farmaci oggi è Istruzione n. 747. Va notato che questo Istruzione è molto obsoleto e non tiene conto di tutti gli aspetti delle moderne attività delle istituzioni mediche (di seguito - LPZ), tuttavia non sono stati adottati nuovi documenti normativi al riguardo. Anche se va notato che c'è speranza per l'adozione nel prossimo futuro di un nuovo documento normativo sulla contabilità di medicinali, medicazioni e altri prodotti medici. Questa speranza è dovuta dall'ordinanza del Consiglio dei ministri dell'Ucraina "Problemi per il rafforzamento della disciplina finanziaria e di bilancio" del 19 gennaio 2011 n. 148-r , che il Ministero della Salute è incaricato di sviluppareentro sei mesi istruzioni per la registrazione di medicinali e medicazioni, nonché dispositivi medici.
In attesa dell'approvazione e dell'entrata in vigore delle nuove disposizioni, i PPP devono continuare ad essere guidati da Istruzione n. 747 .
Secondo Istruzioni n. 747 LPZ tiene conto:
- medicinali - medicinali, sieri e vaccini, materiali vegetali medicinali, acque minerali medicinali, disinfettanti, ecc.;
- condimenti - garze, bende, ovatta, tela cerata e carta a compressione, alignin, ecc.;
- materiali ausiliari - carta cerata, pergamena e filtro, scatole e sacchetti di carta, capsule e cachet, tappi, tappi, fili, firme, etichette, elastici, resina, ecc.;
- contenitore - bicchieri e vasetti con capacità superiore a 5000 ml, flaconi, lattine, scatole e altri imballaggi a rendere, il cui costo non è compreso nel prezzo dei medicinali acquistati, ma è indicato separatamente nelle fatture pagate.
Prestiamo attenzione al fatto che incomma 6 dell'Istruzione n. 747 determinato che nelle farmacie, dipartimenti (uffici) delle istituzionicontabilità soggetto-quantitativa soggetto ai seguenti beni:
medicinali velenosi;
Narcotici;
etanolo;
Nuovi farmaci per la sperimentazione clinica e la ricerca;
Medicinali e medicazioni scarse e costose;
Contenitori (sia vuoti che pieni di medicinali).
Riteniamo che oggi concetti come "nuovi farmaci", "medicinali costosi e scarsi", nel contesto delle attività di un gran numero di farmacie e aziende farmaceutiche, non siano rilevanti.
Prestiamo anche attenzione a quanto segue: nonostante il fatto checomma 6 dell'Istruzione n. 747 contiene un elenco esaustivo di beni materiali soggetti a contabilità quantitativa soggetto, tuttavia, si consiglia vivamente di conservare registrazioni quantitative soggetto di tutti i farmaci che entrano nel LPP, poiché ciò rafforzerà il controllo sul loro utilizzo e preverrà violazioni delle regole per la loro circolazione .
Poiché l'organizzazione della contabilità dei medicinali dipende principalmente dalla disponibilità di una farmacia nella LPP, considereremo questo problema in modo più dettagliato.
Se il LPP ha una farmacia
Si noti che la farmacia dell'istituto dovrebbe essere situata in locali che forniscano condizioni di conservazione adeguate per medicinali e altri beni materiali.
Se c'è una farmacia nella LPZ, i medicinali vengono contabilizzati sia nel reparto contabilità che in farmacia. Allo stesso tempo, i medicinali acquistati e ricevuti dalla farmacia vengono accreditati sulla base diconti fornitore dopo averne verificato la conformità quantitativa e qualitativa. Le fatture fornitori ricevute e verificate vengono registrateLibro di registrazione delle fatture ricevute dalla farmacia (f. n. 6-MZ) , il cui modulo standard è approvato Istruzione n. 747 , firmato dal responsabile che ha effettuato il controllo e l'assunzione dei medicinali, e trasferito all'ufficio contabilità.
Quando viene rilevata una carenza, eccedenza, danni e distruzione di beni materiali, la commissione creata per conto del capo dell'istituzione effettua l'accettazione di beni materiali secondo le istruzioni sulla procedura per ricevere prodotti e merci in termini di quantità e qualità nel modo prescritto (clausola 16 dell'istruzione n. 747 ).
Come definito incomma 18 dell'istruzione n. 747, l'erogazione di medicinali a soggetti finanziariamente responsabili dei dipartimenti (uffici) è effettuata dal capo della farmacia o da un suo sostituto in base alle fatture (requisiti) (f. n. 434). Tuttavia, va notato che attualmente è in vigore un modulo standard. fattura (requisiti) (f. n. 3-3) approvato Ordine n. 130 , che dovrebbe essere utilizzato.
Le fatture (requisiti) sono redatte in duplice copia e contengono i seguenti dati:
Nome completo del medicinale;
La dimensione;
Confezione;
confezione;
Quantità;
prezzo al dettaglio;
Prezzo.
La prima copia della fattura rimane in farmacia, la seconda viene trasferita al responsabile finanziario del reparto che riceve i medicinali. Entrambe le copie sono firmate dal destinatario dei medicinali e dal responsabile della farmacia o da un suo sostituto.
Ogni fattura per la somministrazione di medicinali è tassata dal responsabile della farmacia o da un suo sostituto, dopodiché le fatture vengono registrate secondo l'ordine dei numeri inLibro contabile delle fatture tassate (requisiti) (f. n. 7-MZ). Alla fine del mese, questo libro calcola il totale per ogni gruppo di farmaci e il totale del mese e compilaRelazione della farmacia sulla ricezione e la spesa di medicinali, medicazioni e prodotti medici(f. n. 1-MZ).
La contabilità quantitativa per soggetto dei medicinali in una farmacia nel contesto dei nomi pertinenti viene effettuata inLibro di contabilità soggetto-quantitativa delle scorte di farmacie (f. n. 8-MZ). Viene aperta una pagina separata (o più pagine, se necessario) per ogni nome, confezione, forma di dosaggio, dosaggio dei medicinali. L'emissione di questi medicinali nel dipartimento è emessa da fatture speciali (requisiti) approvate dal capo dell'istituto; contengono il timbro e il sigillo dell'ente, indicano i numeri delle tessere mediche, i cognomi, i nomi ei patronimici dei pazienti ai quali sono prescritti i medicinali. Solo una persona finanziariamente responsabile di un determinato dipartimento (ufficio) riceve tali medicinali. Sulla base di fatture (requisiti) per medicinali dispensati da una farmacia, aElenco di campioni di medicinali usati soggetti a contabilità quantitativa soggetto (f. n. 1-MZ), le cui voci sono fatte per ogni articolo. Il numero totale dei farmaci erogati (a seconda del campione giornaliero) viene trasferito alla f. N. 8-MZ. Sulla base dei documenti ricevuti dalla farmacia nell'ufficio contabilità, la contabilità di questi farmaci viene effettuata in termini monetari per le singole posizioni.
Un dipendente del dipartimento di contabilità dell'ente, a cui è affidata la descrizione del lavoro con i compiti di contabilità dei medicinali, almeno una volta al trimestre, effettua controlli selettivi sulla correttezza della tenuta del libro f. n. 8-MZ, dichiarazioni f. n. 1-MZ e libri f. n. 7-MZ e calcolo dei totali in fatture (requisiti), che è confermato nei documenti verificati dalla firma dell'ispettore (clausola 21 dell'Istruzione n. 747) .
La responsabilità della corretta applicazione dei prezzi al dettaglio, del calcolo del costo dei medicinali nelle fatture (requisiti), dei documenti di spesa e degli elenchi di inventario spetta al capo della farmacia.
Le prime copie delle fatture (requisiti) compilate dalla farmacia, numerate dall'inizio dell'anno, unitamente al libretto f. N. 7-MZ rimangono al capo della farmacia e vengono immagazzinatientro un anno solare (non tenendo conto di quello attuale) vincolato da mesi.
Le fatture (requisiti) per il rilascio dei medicinali soggetti a contabilità soggetto-quantitativa sono conservate dal responsabile della farmaciaentro tre anni .
Al termine dei periodi di conservazione specificati, le fatture (requisiti) possono essere distrutte, a condizione che sia stato effettuato un audit documentale dell'istituto da parte dell'organizzazione di controllo o superiore, durante il quale le domande sulla correttezza delle fatture (requisiti) f. n. 7-MZ e contabilità quantitativa soggetto delle scorte di farmacie f. N. 8-MZ. Sulla distruzione delle lettere di vettura (requisiti) viene redattoAtto , che è approvato secondo le modalità prescritte.
Tuttavia, va notato qui che le autorità GKRS di solito conducono audit delle attività finanziarie ed economiche del PPP, durante i quali vengono verificate anche le questioni di contabilità per medicinali e dispositivi medici, una volta ogni tre anni, quindi tutti i documenti durante questo periodo Dovrebbe essere mantenuto e può essere distrutto solo dopo la revisione.
Il costo dei contenitori non soggetti a cambio e restituzione, incluso dal fornitore nel prezzo dei medicinali, viene ammortizzato al momento dell'annullamento dei medicinali. Se il costo di un contenitore monouso a perdere non è compreso nel prezzo dei fondi ricevuti, ma è indicato separatamente nella fattura del fornitore, tale contenitore, in quanto svincolato dai medicinali in esso confezionati, viene addebitato sul conto di il direttore della farmacia.
Il contenitore di scambio (restituibile), quando consegnato al fornitore o alle organizzazioni di assemblaggio del contenitore, è incluso nella relazione del capo della farmacia e i fondi restituiti all'istituzione sono attribuiti al ripristino delle spese in contanti.
Inoltre, ai sensi dell'art clausola 46 dell'istruzione n. 125 i container sono contabilizzati ai prezzi indicati nelle fatture dei fornitori. In caso di restituzione o vendita di contenitori, la differenza tra il prezzo di acquisto e il prezzo a cui il contenitore è stato venduto,addebitato alle spese effettive .
Alla fine di ogni mese, il responsabile della farmacia redige un rapporto di farmacia sull'incasso e la spesa delle scorte di farmacia in termini monetari (totali) f. n. 11-MZ con l'assegnazione nel verbale dei gruppi di medicinali elencati inIstruzioni n. 747 .
Redazione di una relazione f. Il n. 11-MZ inizia con un'indicazione del saldo del costo dei farmaci per ciascuno dei loro gruppi all'inizio del mese di riferimento. Tali saldi sono trasferiti dalla relazione approvata f. N. 11-MZ per il mese precedente. La ricevuta registra il costo dei medicinali ricevuti dalla farmacia per il mese secondo i conti dei fornitori iscritti al libro f. N. 6-MZ. La parte di spesa rileva il costo dei farmaci erogati dalla farmacia ai reparti (uffici) secondo le fatture (fabbisogni) registrate nella f. N. 7-MZ. Sulla base di atti e altri documenti che costituiscono la base per la cancellazione, vengono registrati anche il costo dei medicinali danneggiati, i contenitori di scambio restituiti (venduti) e le differenze totali rispetto al lavoro di laboratorio e al confezionamento.
Al termine del verbale viene mostrato il saldo del costo dei medicinali e si allegano i documenti, fatta eccezione per le fatture tassate (requisiti), che restano in giacenza presso la farmacia.
Secondo clausola 28 dell'istruzione n. 747 il verbale della farmacia è redatto in duplice copia. La prima copia del verbale è firmata dal responsabile della farmacia e trasmessa al reparto contabilità dell'ente entro e non oltre il 5° giorno del mese successivo al mese di riferimento, o entro i termini approvati dal programma del flusso di lavoro, e il il secondo rimane al capo della farmacia. Dopo aver verificato il rapporto da parte del dipartimento di contabilità e averlo approvato dal capo dell'istituto, il rapporto della farmacia funge da base per cancellare i medicinali esauriti dal dipartimento di contabilità dell'istituto.
Tuttavia, notiamo che cancellare le droghe basato sul rapporto della farmacia solo sbagliato . Ciò è dovuto al fatto chela cancellazione dei medicinali nella contabilità dovrebbe essere effettuata al momento del loro utilizzo (Questo sarà discusso in modo più dettagliato nella sottosezione sull'eliminazione dei medicinali). Dalla farmacia, i medicinali vengono consegnati alle infermiere senior dei reparti, che sono persone finanziariamente responsabili. Poiché i medicinali vengono utilizzati, gli infermieri senior li includono nei rapporti che presentano mensilmente al dipartimento di contabilità, e sono questi rapporti che costituiscono la base per cancellare i medicinali nei registri contabili della LPZ.
Se la LPZ non ha una farmacia
Le PPL che non dispongono di farmacie proprie devono acquistare i medicinali dalle farmacie statali e autosufficienti secondo le modalità previste dall'accordo tra le stesse. La ricezione di medicinali in questa forma di organizzazione di un istituto medico viene effettuata sotto forma di forniture pianificate. Ciò significa che gli accordi tra la farmacia e l'istituto medico sono sistematici. Di solito, l'istituto medico trasferisce periodicamente l'importo dei fondi previsti dall'accordo al fornitore. Il fornitore (farmacia), a sua volta, dispensa sistematicamente medicinali all'istituto medico su sua richiesta (per conto), senza richiedere il pagamento per ogni caso di dispensazione di medicinali. Per i medicinali dispensati per un determinato periodo, il fornitore emette fattura con allegati documenti giustificativi. Il reparto contabilità dell'istituto medico controlla tali conti e li accetta per l'esecuzione. Allo stesso tempo, viene specificato e regolamentato lo stato degli accordi con il fornitore (farmacia) per i medicinali ricevuti.
I medicinali sono dispensati da una farmacia a un istituto medico secondospese generali (requisiti) f. n. 3-3, che sono prescritti dalla caposala di ciascun dipartimento dell'istituto per i gruppi di farmaci in quattro copie e per i farmaci soggetti a contabilità quantitativa soggetto, in cinque copie; di cui due copie delle fatture (requisiti) sono ricevute da LPZ; in farmacia rimangono due copie (e per i medicinali soggetti a contabilità quantitativa soggetto - tre copie).
Il ricevimento dei medicinali dalla farmacia è effettuato dai soggetti finanziariamente responsabili dei reparti (infermiere senior) per delega. I medicinali ricevuti sono conservati nei reparti.
Secondo clausola 37 dell'istruzione n. 747 ricevuta di medicinali da una farmacia autosufficiente, confermano le persone finanziariamente responsabili della LPZdipinto a mano su tutte le copie delle fatture (requisiti), mentre ne riceve una copia, tassata per ogni forma di dosaggio al centesimo intero, e il farmacista firma l'emissione dei medicinali e la correttezza della tassazione su tutte le copie delle fatture (requisiti).
Secondo clausola 39 dell'istruzione n. 747 negli ambulatori i medicinali soggetti a contabilità quantitativa soggetto sono prescritti dal capo infermiere (senior) su fatture separate (requisiti), li ricevono da una farmacia autoportante e li consegnano al reparto (uffici) per le necessità correnti.
La contabilità dei medicinali soggetti alla contabilità quantitativa per soggetto è tenuta dal capo infermiere (senior) secondo le modalità prescrittecomma 7 dell'istruzione n. 747 . Alla fine di ogni mese, l'infermiera capo (senior) si presenta al dipartimento di contabilità Relazione sulla circolazione dei medicinali soggetti a contabilità quantitativa soggetto , secondo f. n. 2-MZ (di seguito denominato il Rapporto), che è approvato dal capo dell'ente.
Va notato che in pratica la situazione è alquanto diversa. Gli infermieri senior dei dipartimenti sono persone finanziariamente responsabili, e sono loro che redigono un rapporto mensile e lo sottopongono all'ufficio contabilità.
Facciamo un esempio del Report, che deve essere presentato mensilmente all'ufficio contabilità dalle caposala dei reparti o da altri soggetti finanziariamente responsabili.
CONTABILITÀ DEI MEDICINALI
Secondo clausola 44 dell'istruzione n. 747 a responsabilità contabili LPZ includono:
Garantire la corretta organizzazione della contabilità dei medicinali;
Controllo sulla tempestiva e corretta esecuzione degli atti e sulla liceità delle operazioni in corso;
Controllo sull'uso corretto, economico e previsto dei fondi stanziati per l'acquisto di medicinali, la loro sicurezza e circolazione;
Controllo costante sulla corretta manutenzione nei reparti (uffici) dell'istituzione della contabilità soggetto-quantitativa dei farmaci;
Partecipazione all'inventario dei medicinali, determinazione tempestiva e corretta dei suoi risultati e loro riflessione nella contabilità.
I medicinali sono parte integrante delle scorte delle istituzioni di bilancio, quindi la loro contabilità dovrebbe essere effettuata in conformità con i requisiti Istruzioni n. 125 .
Le registrazioni contabili dei pagamenti per i medicinali, che vengono effettuati nell'ordine dei pagamenti pianificati, sono conservatemandato commemorativo n. 7 "Rendiconto cumulativo delle transazioni nell'ordine dei pagamenti programmati" f. No. N. 410 (bilancio).
La contabilità è tenuta separatamente per ciascun fornitore, per il quale è allocato il numero di righe necessario per riflettere le transazioni avvenute nel mese nell'ambito dei codici di classificazione economica delle spese. Le registrazioni nel rendiconto cumulativo vengono effettuate per ciascun documento (ordine di pagamento, conto, ecc.) man mano che si effettuano le operazioni.
Le operazioni sugli insediamenti nell'ordine dei pagamenti pianificati, eseguite a spese del fondo speciale, sono condotte in un ordine separato.
Secondo clausola 26 dell'istruzione n. 125 medicinali, componenti, battericidi, disinfettanti, sieri, vaccini, sangue, pellicole radiografiche, materiali per test e medicazioni, piccola attrezzatura medica(termometri, lancette, pinzette, aghi, ecc.) di enti le cui stime includono tali costi secondo il codice di classificazione economica dei costi 1132" Vengono presi in considerazione medicinali e medicazioni”.sul conto secondario 233 "Medicinali e medicazioni". Questo sottoconto tiene conto anche dei materiali ausiliari e farmaceutici nelle istituzioni mediche che dispongono di farmacie proprie.
Tara dovrebbe essere preso in considerazionesul conto secondario 236" Tara» (clausola 29 dell'Istruzione n. 125) .
Per registrare le transazioni sulla spesa di medicinali, viene utilizzatomandato commemorativo numero 13" Dichiarazione cumulativa di spesa dei materiali.
Le registrazioni sull'addebito dei sottoconti che corrispondono ai sottoconti materiali vengono effettuate nel contesto dei codici di classificazione economica delle spese.
L'ordine commemorativo è firmato dall'esecutore testamentario, dalla persona che ha verificato l'ordine commemorativo e dal capo contabile.
Ecco le principali scritture contabili relative alla ricezione e allo storno di medicinali.
|
Corrispondenza dei sottoconti |
|||
|
Ha ricevuto finanziamenti per l'acquisto di medicinali |
|||
|
L'importo è stato trasferito ai fornitori di farmaci secondo le fatture: |
|||
|
Nell'ordine dei pagamenti previsti |
|||
|
Con pagamento anticipato* |
|||
|
Dopo aver ricevuto i farmaci |
|||
|
Medicinali ricevuti: |
|||
|
Pagato secondo l'ordine dei pagamenti pianificati |
|||
|
Pagato con pagamento anticipato |
|||
|
In termini di pagamento del loro costo dopo il ricevimento |
|||
|
L'importo dell'IVA pagata al fornitore per i medicinali viene addebitato |
|||
|
Il costo dei servizi per la consegna dei medicinali è stato ammortizzato come spese |
|||
|
Pagamento per servizi per la consegna di medicinali |
|||
|
Medicinali ricevuti in natura (sotto forma di beneficenza, aiuti umanitari)** |
|||
|
Il costo dei medicinali utilizzati per il trattamento dei pazienti è stato ammortizzato: |
|||
|
Acquisito dal fondo generale |
|||
|
Acquisito con fondi di un fondo speciale |
|||
|
Ricevuto sotto forma di aiuti umanitari e di beneficenza |
|||
|
* Ai sensi dei paragrafi. 2 comma 1 del Decreto n. 1404, il pagamento anticipato di medicinali e dispositivi medici può essere effettuato per un periodo non superiore a un mese ** Entro e non oltre l'ultimo giorno lavorativo del mese viene presentata una ricevuta in natura all'Ente del Tesoro dello Stato. |
|||
Ci sono casi in cui i medicinali vengono consegnati all'LPZ sotto forma di aiuto umanitario.
Come definito incomma 35 dell'istruzione n. 125, le scorte ricevute sotto forma di aiuto umanitario sono accettate da una commissione istituita per ordine del capo dell'istituzione, che deve includere un contabile e un rappresentante di un'organizzazione di livello superiore. La commissione redige un atto che indica i nomi, la quantità e il valore dei beni materiali ricevuti a prezzi di mercato per le loro tipologie simili. I dati dell'atto si riflettono nelle scritture contabili.
Le persone contabili e materialmente responsabili tengono registri delle scorte ricevute come aiuti umanitari in modo generale, maseparatamente dalle scorte acquisite dall'ente a spese dei fondi generali o speciali del preventivo entrate e spese.
Prestiamo attenzione anche a quanto segue. Non è un segreto per nessuno che non sempre LPZ possa fornire ai pazienti i farmaci necessari alle cure, che verranno acquistati a spese del budget. Purtroppo, al momento, la maggior parte dei PLZ non è completamente fornita di medicinali per il trattamento dei pazienti secondo le indicazioni mediche. Ciò porta alla necessità di utilizzare alcuni farmaci acquistati a spese dei pazienti.
In pratica, tali medicinali sono contabilizzati sotto forma di assistenza caritatevole mirata ricevuta da individui in natura o non si riflettono affatto nella contabilità.
Secondo Clausola 8 dell'ordinanza n. 1295 persone giuridiche - gli acquirenti dell'assistenza caritatevole nel loro bilancio annuale riflettono separatamente i fondi (beni, lavori, servizi) ricevuti come assistenza caritatevole. Pertanto, devono essere contabilizzati separatamente.
Comunque, in ogni caso, medicinali acquistati a proprie spese , segue differire dai farmaci acquistati dall'ente, le relative note nei foglietti delle prescrizioni medicinali.
SCOPERTA DEI MEDICINALI
La base per cancellare il dipartimento di contabilità dell'istituto dei medicinali per la contabilità è il rapporto, che viene compilato dalle persone finanziariamente responsabili dei dipartimenti dell'istituto. Si segnala che la Relazione riflette cancellare solo quei medicinali che sono già effettivamente utilizzati per il trattamento dei pazienti . I medicinali non dovrebbero essere riportati nella relazione in quanto utilizzati e soggetti a cancellazione, se sono rilasciati solo dalla persona finanziariamente responsabile del dipartimento al posto o ad altre divisioni strutturali del dipartimento per un ulteriore utilizzo per il trattamento dei pazienti.
Ciò è dovuto al fatto che incomma 5 dell'art. 9 della Legge Contabile si precisa che le transazioni commerciali devono essere riportate nei registri contabili nel periodo di rendicontazione in cui sono stati effettuati .
Per i dipartimenti che hanno unità strutturali (posta, manipolazione, ecc.) nella loro composizione, è opportuno organizzare mensilmente la fornitura da parte di tali unità al responsabile finanziario del dipartimento di informazioni operative sull'uso effettivo dei farmaci per il trattamento dei pazienti prima della compilazione del Report.
L'uso effettivo dei medicinali deve essere confermato da registrazioni nel foglio delle prescrizioni. Il foglio illustrativo delle prescrizioni medicinali è un documento operativo destinato alla registrazione della degenza del paziente in ospedale, dell'alimento dietetico a lui prescritto, dei metodi di esame,trattamento farmacologico , procedure fisioterapiche e psicoterapeutiche.
Secondo comma 1 dell'art. 9 della Legge Contabile le basi per la contabilizzazione delle transazioni commerciali sono documenti primari che registrano i fatti delle transazioni commerciali.La cancellazione di medicinali senza documenti giustificativi nell'elenco delle prescrizioni sul loro uso effettivo è considerata irragionevole ed è una violazione comma 1 dell'art. 9 della Legge Contabile .
Secondo clausola 69 dell'istruzione n. 125 la cancellazione dal bilancio dell'ente di oggetti, strumenti, produzione, elettrodomestici e altre scorte di basso valore e usurati che sono diventati inutilizzabili è effettuata sulla base dicancellazioni (a meno che non sia stabilita una diversa procedura di cancellazione da parte del ministero competente, altra autorità esecutiva centrale).
Tuttavia, nel caso di cancellazione di medicinali da LPZ, l'elaborazione di atti di cancellazione ogni volta non è appropriato. I medicinali vengono cancellati dai dipartimenti contabili della LPZ sulla base di rapporti che svolgono la funzione di atti di cancellazione.
Passiamo ora a considerare la contabilizzazione di alcuni tipi di medicinali e prodotti medici.
CONTO DEGLI NARCOTICI E DELLE SOSTANZE PSICOTROPE
A Arte. 1 della legge sugli stupefacenti determinato che droghe sono sostanze, preparati, piante naturali o sintetiche compresi inElenco n. 770 .
Inoltre, vi sono stupefacenti e sostanze psicotrope soggette a controlli speciali. Sono definiti inElenco numero 7 .
Anche Elenco n. 7 contiene stupefacenti e sostanze psicotrope chehanno un valore terapeutico dubbioso , sono vietati la produzione in Ucraina, l'uso per scopi medici e non sono soggetti a inclusione nei libri di riferimento dei medicinali, nel registro statale e nella farmacopea statale dell'Ucraina. Tali farmaci LPP Non ne hanno il diritto uso.
Secondo Arte. 21 della legge sulla droga nella pratica medica possono essere utilizzati stupefacenti, sostanze psicotrope comprese nelle tabelle II e IIIElenco n. 770 e precursori inclusi nella tabella IV Elenco n. 770 .
LPZ svolge attivitàSu acquisizione, conservazione e uso di stupefacenti e sostanze psicotrope . Tutte queste attività sono conformi soggetto a licenza . Un'unica licenza può essere rilasciata per diversi tipi di attività legate alla circolazione di stupefacenti e sostanze psicotrope,per un periodo di cinque anni . Senza autorizzazione in un ente sanitario per svolgere attività legate alla circolazione di stupefacenti e sostanze psicotrope, proibito .
L'autorità competente per il rilascio delle licenze è l'autorità esecutiva centrale autorizzata dal Gabinetto dei Ministri dell'Ucraina a svolgere attività di licenza nel campo del traffico di stupefacenti e sostanze psicotrope.
Per ottenere una licenza, l'autorità di rilascio delle licenze deve presentare i documenti specificatiArte. 10 della Legge sulle Licenze , ovvero: informazioni sull'entità aziendale e sul tipo di attività economica per la quale il richiedente intende ottenere una licenza.
Inoltre, secondo Arte. 8 della legge sulla droga necessario fornire all'autorità competente per il rilascio delle licenze le seguenti informazioni e documenti:
Un certificato (certificato, certificato di uno specialista) che conferma l'idoneità professionale del capo dell'entità giuridica o del capo della divisione pertinente della persona giuridica a svolgere attività autorizzate per la circolazione di stupefacenti, sostanze psicotrope e precursori;
Un certificato dell'istituzione sanitaria statale o municipale competente attestante che i dipendenti che, in conformità con i loro doveri ufficiali, riceveranno (o avranno) accesso diretto a stupefacenti, sostanze psicotrope e precursori, non hanno disturbi mentali associati all'abuso di bevande alcoliche, stupefacenti o sostanze psicotrope, nonché sull'assenza tra questi dipendenti di soggetti riconosciuti inadatti a determinati tipi di attività (lavori, professioni, servizi) connessi alla circolazione di stupefacenti, sostanze psicotrope e precursori, nella modalità stabilite dal Consiglio dei Ministri;
Certificato del Ministero degli Affari Interni dell'Ucraina sull'assenza di dipendenti che, in base alle loro funzioni ufficiali, riceveranno (o avranno) accesso direttamente a stupefacenti, sostanze psicotrope e precursori, non sono stati rimossi o non cancellati nel modo prescritto , una condanna per aver commesso reati moderati, gravi e particolarmente gravi o per reati connessi al traffico illecito di stupefacenti, sostanze psicotrope e precursori, compresi quelli commessi al di fuori dell'Ucraina;
Autorizzazione del Ministero degli affari interni dell'Ucraina per l'uso di strutture e locali destinati all'attuazione di attività per la circolazione di stupefacenti, sostanze psicotrope e precursori.
Licenza rilasciataentro tre giorni lavorativi , a partire dalla data di ricezione del documento attestante il pagamento del rilascio della licenza.
Se la LPZ ha suddivisioni separate che svolgono attività relative alla circolazione di stupefacenti e sostanze psicotrope, l'autorità di rilascio delle licenze rilascia copie certificate della licenza rilasciata per ciascuna di esse.
Va tenuto presente che, ai sensi dell'art Clausola 18 dell'ordinanza n. 1387 viene rilasciata una nuova licenzanon prima dell'ultimo giorno lavorativo della licenza precedentemente rilasciata . Licenza non rinnovata a tempo debitonon valido .
Il canone è determinato in base a Decreto n. 1755 . Sì, in conformità convoce 1 1 questo decreti il canone per l'ottenimento dell'abilitazione all'esercizio di tipi di attività economica èun salario minimo in base alla sua entità, con effetto alla data della decisione dell'autorità di rilascio della licenza, fatta eccezione per il canone, il cui importo è stabilito dalla legge.
Il principale documento normativo che regola la circolazione di stupefacenti e sostanze psicotrope nella LPZ è Ordine n. 11 .
In connessione con il maggiore controllo sulle attività legate alla circolazione di stupefacenti e sostanze psicotrope, la documentazione delle transazioni dovrebbe essere effettuata a partire dall'acquisizione di tali farmaci da parte delle istituzioni sanitarie e concludersi con la distruzione delle fiale vuote dopo il loro utilizzo.
Secondo Clausola 1 dell'ordinanza n. 11 gli stupefacenti, le sostanze psicotrope ei precursori devono essere immagazzinati nella ZPSin stanze separate attrezzato secondoRequisiti n. 216 .
I locali, le casseforti e gli armadi metallici negli istituti sanitari in cui sono conservati stupefacenti, sostanze psicotrope e precursori, dopo le operazioni con gli stessi, devono essere chiusi e, dopo la fine della giornata lavorativa, devono essere sigillati o sigillati e posti sotto custodia.
Le chiavi di casseforti, armadietti metallici e locali in cui sono conservati stupefacenti, sostanze psicotrope e precursori e i sigillanti devono essere custoditi da persone autorizzate per ordine del capo della LPZ responsabile della loro sicurezza. L'elenco di queste persone, la procedura per la consegna di chiavi e sigillanti da casseforti, armadi metallici e locali in cui sono conservati i suddetti fondi e sostanze sono determinati e approvati per ordine capo della LPZ.
Sono determinate le persone finanziariamente responsabili e le persone che, in base alle mansioni, accedono alla circolazione di stupefacenti, sostanze psicotrope e precursoriordine del capo dell'ente sanitario . Con questo ordine, queste persone
I documenti sulla circolazione di stupefacenti, sostanze psicotrope e precursori nella ZLP devono essere conservati in condizioni che ne garantiscano la completa sicurezza per almeno cinque anni, non tenendo conto dell'anno in corso.
Al termine del periodo di conservazione devono essere presentati i documenti sulla circolazione di stupefacenti, sostanze psicotrope e precursori essere distrutto bruciando commissione per la distruzione di atti sulla circolazione di stupefacenti, sostanze psicotrope e precursori nella ZLP, il cui periodo di conservazione è scaduto, con redazione di atto sotto qualsiasi forma sulla distruzione firmato da tutti i membri di detta commissione.
Sono obbligate le istituzioni sanitarie che svolgono attività legate alla circolazione di stupefacenti, sostanze psicotrope e precursorieffettuare un inventario trimestrale secondo le modalità previste dalla legge con la predisposizione di un bilancio delle voci di magazzino nella forma ai sensi dell'art Allegato 6 a Ordine n. 589 .
Informazioni sulle discrepanze nel saldo delle voci di inventario o discrepanza tra gli indicatori di bilancio e i risultati dell'inventarioentro tre giorni di calendario dopo la loro identificazione, sono presentati da un ente sanitario:
Ministero degli Affari Interni - per le operazioni svolte all'interno del territorio dell'Ucraina;
Ministero dell'Interno e SBU - per le operazioni di import-export.
Medicinali, dispositivi medici sono venduti dalla LPP in conformità conrequisiti-ordini , il cui ordine di esecuzione è determinato Regolamento n. 360 .
Viene effettuata la ricezione di stupefacenti, sostanze psicotrope e precursori da fornitori di LPZcon procure separate indicando i nomi e le quantità a parole di tutti i fondi e le sostanze ricevute.
Si noti che di solito la persona finanziariamente responsabile per l'ottenimento di tali farmaci nel caso di una farmacia come parte del LPP lo èfarmacista . Se non c'è una farmacia nel LPP, il gestore seleziona una persona finanziariamente responsabile che sarà responsabile dell'acquisto di stupefacenti dalle farmacie comunali e statali. Molto spesso, questa persona viene nominatacapo infermiera LPZ o un'infermiera del reparto in cui la circolazione di stupefacenti è maggiore, ad esempio il caposala del reparto chirurgico o il blocco operatorio. Tale persona deve garantire la sicurezza degli stupefacenti e degli psicofarmaci durante la ricezione e il trasporto. Il capo della LPZ deve fornire a una persona finanziariamente responsabile i veicoli e un conducente.
Al ricevimento di stupefacenti, sostanze psicotrope e precursori dalle farmacie sanitarie, il responsabile finanziario dell'istituto sanitario che li riceve, è tenuto a verificarne il nome e il numero rilasciato fondi per il rispetto delle denominazioni e delle quantità indicate nelle fatture (fatture, fatture).
I reclami riguardanti la rottura delle fiale, il matrimonio (la loro pienezza incompleta, la marcatura sfocata, ecc.), la data di scadenza o l'esaurimento, ecc., nonché le stesse affermazioni relative a compresse e confetti (angro) negli imballaggi di fabbrica o farmacia devono essere presentati all'indirizzo il momento del ricevimento (ricezione) di stupefacenti, sostanze psicotrope e precursori in presenza di soggetti finanziariamente responsabili del fornitore.
Va notato che può essere effettuato lo stoccaggio di stupefacenti, sostanze psicotrope e precursori nella LPZ in volumi non eccedenti il requisito di due settimane previsto dall'istituto .
Allo stesso tempo, nel dipartimenti Può essere effettuato lo stoccaggio LPZ di stupefacenti, sostanze psicotrope e precursoriin volumi non eccedenti il loro fabbisogno di tre giorni .
Sul messaggi (negli uffici) Deposito LPZ di stupefacenti, sostanze psicotrope e precursori possonoessere effettuato in volumi non superiori a quelli giornalieri e nei fine settimana (festivi) - un requisito di tre giorni per loro.
A ufficio ammissioni ospedale per fornire ai pazienti cure mediche di emergenza la sera e la notte secondo le indicazioni vitali è possibile creare una riserva di cinque giorni stupefacenti, sostanze psicotrope e precursori, che possono essere utilizzati con il permesso del medico di turno in altri reparti dell'ospedale di questa istituzione.
Il calcolo dei volumi di stoccaggio degli stupefacenti, delle sostanze psicotrope e dei precursori in genere per la ZLP, nonché nell'ambito dei reparti e delle poste (uffici) è approvato con provvedimento del responsabile dell'istituto di cura e prevenzione sanitaria.
Nella ZPS, nei luoghi in cui sono conservati stupefacenti, sostanze psicotrope e precursori, oltre agli elenchi di tali farmaci con dosi singole e giornaliere più elevate, dovrebbero essere presenti tabelle di antidoti (antidoti) in caso di avvelenamento da parte dei suddetti farmaci e sostanze.
La nomina di stupefacenti, sostanze psicotrope e precursori ai pazienti dovrebbe essere effettuata dai medici della LPZ secondo indicazioni mediche:
Nei reparti di degenzavolantino medici che prescrivono stupefacenti e psicotropi e che adempiono a tali prescrizioni secondo il moduloAllegato 4 a numero d'ordine 11 con iscrizione obbligatoria all'anamnesi ;
Negli ambulatori e negli ambulatori, anche negli ospedali a domicilio, -nelle schede ambulatoriali .
Il foglio degli appuntamenti deve essere conservatonelle cartelle cliniche primarie malato.
Si prega di notare che la forma di questo foglio è diversa dal foglio di prescrizione per i medicinali convenzionali. Prevede registrazioni del nome del narcotico o psicotropo, della data di prescrizione, dell'ora della somministrazione. Firma del medico su questo foglio conferma la prescrizione di farmaci e la firma dell'infermierala loro effettiva introduzione .
Separatamente si segnala che i dati sui nomi, l'ora, il dosaggio degli stupefacenti e delle sostanze psicotrope indicati nel diario della tessera sanitaria,deve rispettare pienamente secondo il foglio illustrativo delle prescrizioni dei medici di stupefacenti e psicofarmaci e l'adempimento di tali prescrizioni.
Facciamo un esempio di Elenco delle prescrizioni dei medici per stupefacenti, sostanze psicotrope e precursori (farmaci) e l'adempimento di tali prescrizioni.
Durante gli interventi chirurgici vengono spesso utilizzati stupefacenti e sostanze psicotrope a scopo di premedicazione, cioè sotto forma di anestetico. In questo caso, la loro applicazione dovrebbe riflettersi inScheda di anestesia .
La decisione di prescrivere farmaci ai pazienti per più di tre giorni obbligato ad accettarecommissione sull'opportunità di prescrivere stupefacenti alla LPZ con l'approvazione obbligatoria di questa decisione da parte del primario o del suo sostituto per l'attività medica. La composizione di questa commissione deve essere approvata dall'ordine del capo della LPZ. Con tale ordinanza, il presidente della commissione ei membri della commissionedeve essere familiarizzato con una firma personale.
La decisione della suddetta commissione è redatta nel modulo Conclusioni sulla prescrizione di stupefacenti in due copie secondo il moduloAllegato 5 a numero d'ordine 11 . Questa conclusione dovrebbe essere conservata nella cartella clinica primaria del paziente.
Nella LPZ, dovrebbero essere presi in considerazione gli stupefacenti, le sostanze psicotrope e i precursori immagazzinati nei luoghi di concentrazione del fabbisogno di due settimane dell'istituzione inGiornale di registrazione di stupefacenti, sostanze psicotrope e precursori, preparati (farmaci) nella forma secondo Allegato 5 a Ordine n. 589 .
Nei dipartimenti, uffici della LPZ, gli stupefacenti, le sostanze psicotrope e i precursori devono essere contabilizzati inGiornale di registrazione di stupefacenti, sostanze psicotrope e precursori nei dipartimenti e negli uffici di un'istituzione sanitaria medica e preventiva secondo la forma Allegato 6 a numero d'ordine 11 .
Presso le postazioni dei reparti e negli uffici del policlinico della LPZ, stupefacenti, sostanze psicotrope e precursoriRiviste di registrazione di stupefacenti, sostanze psicotrope e precursori presso le cariche dei dipartimenti di un'istituzione sanitaria medica e preventiva secondo la forma allegato 7 a numero d'ordine 11 .
I registri di registrazione di stupefacenti, sostanze psicotrope e precursori nei dipartimenti e uffici di LPZ e i registri di stupefacenti, sostanze psicotrope e precursori presso i posti dei dipartimenti di LPZ dovrebbero esserenumerata, allacciata e certificata con il sigillo di LPZ e firma della testa .
Vice primario per il lavoro medico (policlinico), capi di dipartimento e, in loro assenza, capi della LPZ almeno una volta a settimana deve verificare l'effettiva presenza di stupefacenti, sostanze psicotrope e precursori negli istituti di cura e prevenzione sanitaria (dipartimenti, uffici, posti) e confrontarne i saldi con i registri. Sul fatto di condurre tale ispezione, le persone che l'hanno effettuata deve fare idonee iscrizioni nei registri .
La Commissione sull'opportunità di prescrivere stupefacenti, sostanze psicotrope e precursori è obbligataalmeno una volta al mese verificare nei dipartimenti e negli uffici della LPZ lo stato delle cose in materia di conservazione, prescrizione, uso di stupefacenti, sostanze psicotrope e precursori e distruzione di fiale vuote da sotto di esse.
Secondo Clausola 1 dell'ordinanza n. 11 in ogni struttura sanitariaper ordine dovrebbe essere creato il capo dell'istituzione sanitariacommissione per la distruzione di fiale vuote da stupefacenti, sostanze psicotrope e precursori usati.
Approvata la composizione della commissione (almeno tre persone presiedute dal responsabile dell'ente sanitario o suo delegato) e la procedura per la restituzione delle fiale vuote da stupefacenti, sostanze psicotrope e precursori usatiper ordine capo di una struttura sanitaria.
Fiale vuote da sostanze stupefacenti, psicotrope e precursori usatiquotidiano , ad eccezione dei fine settimana e dei giorni festivi, devono essere consegnati da soggetti finanziariamente responsabili alla commissione per la distruzione delle fiale vuote degli stupefacenti, delle sostanze psicotrope e dei precursori usati.
Dovrebbe essere eseguita la distruzione di fiale vuote da stupefacenti, sostanze psicotrope e precursori usati almeno una volta ogni dieci giorni di calendario , di cui subito dopo la distruzione deve essere redatto e sottoscritto da tutti i membri della commissioneatto di distruzione di fiale vuote da stupefacenti usati, sostanze psicotrope e precursori nelle istituzioni sanitarie dell'Ucraina secondo il moduloAllegato 1 a numero d'ordine 11 .
Diamo una rapida occhiata alla scritturamoduli di prescrizione speciali per ottenere stupefacenti e sostanze psicotrope.
Le regole per la loro emissione sono definite Clausola 4 dell'ordinanza n. 11 .
I medici della LPZ, indipendentemente dalla loro forma di titolarità e subordinazione, secondo le tipologie di studio medico per il quale è stata rilasciata l'autorizzazione dal Ministero della Salute, e secondo la loro posizione medica, se vi sono indicazioni mediche rilevanti, sono tenuti di rilasciare prescrizioni ai pazienti per il diritto a ricevere un medicinale contenente uno stupefacente, una sostanza psicotropa o un precursore in forma pura o miscelata con sostanze indifferenti, sumodulo di prescrizione speciale modulo n. 3 /f-3/ secondo il moduloAllegato 8 a numero d'ordine 11 .
Forme speciali di prescrizione del Modulo n. 3 /f-3/, emesse in violazioneOrdine n. 11, sono considerati non valido e medicine per loro non prodotto o rilasciato .
La contabilizzazione dei moduli di prescrizione speciali del modulo n. 3 / f-3 / per la prescrizione di stupefacenti e psicotropi viene effettuata in conformità conOrdine n. 573 come moduli di segnalazione rigorosi .
Tutti i documenti relativi alla ricezione e al rilascio dei moduli speciali di prescrizione del modulo n. 3 / f-3 / devono essere conservati presso la LPZ entro cinque anni , escluso l'anno in corso.
Al termine dei relativi periodi di conservazione, tutti i documenti relativi alla ricezione e al rilascio di speciali moduli di prescrizione del modello n.distruzione per incenerimento commissione per la distruzione dei registri speciali e dei moduli speciali di prescrizione del modulo n. 3 / f-3 /, la cui composizione è approvataper ordine il capo della LPZ, con la predisposizione del relativo atto in qualsiasi forma firmato da tutti i membri della commissione.
Notiamo inoltre che alcuni farmaci contengono una piccola quantità di sostanze stupefacenti e possono essere dispensati senza prescrizione medica. I tipi di tali farmaci sono definitiOrdine n. 210 .
PRESCRIZIONE DI FARMACI SECONDO RICETTE
Allo stato attuale, questo problema è regolamentato Regolamento n. 360 . L'effetto di questi Regole si applica a tutte le istituzioni sanitarie, indipendentemente dalla loro forma di proprietà e subordinazione.
Secondo Clausola 1 del Regolamento n. 360 le prescrizioni di medicinali e dispositivi medici sono rilasciate dai medici delle istituzioni sanitarie, indipendentemente dalla proprietà e dalla subordinazione, secondo i tipi di pratica medica per cui è stata rilasciata una licenza dal Ministero della Salute dell'Ucraina e in conformità con le posizioni mediche.
Prescrizioni di medicinali, dispositivi medici,rilasciato a condizioni preferenziali o gratuitamente , è consentito prescrivere ai medici delle istituzioni sanitarie statali e comunali d'intesa con le autorità sanitarie delle amministrazioni locali dello Stato.
Lo sono i professionisti medici autorizzati a scrivere prescrizioniresponsabile della prescrizione dei farmaci al paziente e il rispetto delle regole per la scrittura di prescrizioni in conformità con la legislazione dell'Ucraina.
Le prescrizioni vengono rilasciate al paziente in presenza di idonee indicazionicon annotazione obbligatoria della prescrizione di medicinali o dispositivi medici nella cartella clinica(anamnesi, cartella clinica di un paziente ambulatoriale o ospedaliero).
Cioè, se la documentazione medica (anamnesi, cartella clinica di un paziente ambulatoriale o ricoverato) non contiene un record di prescrizione di un medicinale e una prescrizione è stata scritta, tale prescrizione viene scrittairragionevolmente .
Se un rimborso del costo dei medicinali è stato effettuato in base a tale prescrizione dal PPP (ad esempio, la prescrizione è preferenziale), l'importo di tale rimborso èspesa illecita di fondi pubblici .
Esattamente prescrizioni preferenziali sono del massimo interesse per le autorità di regolamentazione, perché il costo dei medicinali prescritti in base a tali prescrizioni è rimborsato dal bilancio.
Le prescrizioni devono avere un timbro d'angolo di un'istituzione sanitaria ed essere certificate dalla firma e dal sigillo personale di un medico.
Ricette deve essere dimesso sul:
farmaci da prescrizione;
Farmaci da banco, prodotti medici nel caso in cui siano dispensati gratuitamente oa condizioni preferenziali;
Medicinali prodotti in farmacia per un paziente specifico.
Le prescrizioni di medicinali, ad eccezione dei medicinali narcotici (psicotropi), e di dispositivi medici sono rilasciate su moduli di prescrizione f-1, la cui forma è data in allegato 1 a Regolamento n. 360 .
Le prescrizioni di stupefacenti (psicotropi) in forma pura o miscelate con sostanze indifferenti vengono emesse su appositi moduli di prescrizione f-3.
Sui moduli di prescrizione f-1 è consentito trascrivere non più di tre elementi medicinali.
Un nome il farmaco è prescritto in caso di appuntamento:
Medicinali soggetti a contabilità quantitativa soggetto;
Farmaci narcotici (psicotropi) nella forma f-3;
Preparati insulinici, il cui costo è soggetto a rimborso statale.
Prescrizioni per medicinali soggetti a contabilità quantitativa soggetto, dispensatia condizioni preferenziali o gratuitamente , ad eccezione degli stupefacenti (psicotropi), sono prescritti in duplice copia sul modulo f-1.
CONTO ALCOOL
Quasi tutti i rami della LPZ utilizzano nelle loro attivitàetanolo .
La cancellazione dell'alcol etilico viene effettuata in conformità con gli standard approvatinumero d'ordine 245.
I tassi di consumo di alcol etilico dipendono dal profilo della suddivisione LPP. L'alcol etilico viene cancellato per una visita ambulatoriale (per poliambulatori e ambulatori), per un giorno di degenza (per ospedali), per una procedura (per laboratori, manipolazioni e altre sale di trattamento). Inoltre, l'alcol etilico viene utilizzato per il trattamento di strumenti medici.
Per inserire la quantità di alcol cancellato nel rapporto, la persona finanziariamente responsabile del dipartimento deve calcolare il numero di procedure (visite, manipolazioni, ecc.) Per il periodo di riferimento e moltiplicarle per il tasso di cancellazione dell'alcol secondo a Ordine n. 245 .
Tutte le norme per l'uso dell'alcol etilico, date in Ordine n. 245 , sono definiti in grammi e pertanto la contabilizzazione dell'alcol dovrebbe essere mantenuta in grammi (chilogrammi).
Abbastanza spesso ci sono casi in cui LPZ riceve alcol etilico dalle farmacie in bottiglie, dove la quantità di alcol è indicata in unità di volume - millilitri. Questo importo deve essere convertito in grammi. Per fare una tale traduzione, dovresti conoscere la densità dell'alcol, che può essere trovata in tabelle speciali.
Per chiarezza, presentiamoesempio .
LPZ ha ricevuto il 70% di alcol etilico da una farmacia - 20 bottiglie da 100 ml ciascuna.
Massa di alcol = volume di alcol x densità di alcol.
Per determinare la densità del 70% di alcol, è necessario utilizzare le tabelle alcolmetriche, che forniscono tali dati. Tali tabelle possono essere trovate in libri farmaceutici speciali (ad esempio, la Farmacopea di Stato) o in altre fonti.
Quindi, secondo la tabella alcolmetrica, il 70% di alcol ha una densità di 0,8858 0,886.
Massa di alcol = volume di alcol x densità di alcol = = 100 ml X 0,886 = 88,6 g
Quindi 100 ml Il 70% di alcol equivale a 88,6G 70% di alcol.
Nel nostro caso, la LPZ ha ricevuto 20 bottiglie di alcol al 70%, 100 ml ciascuna, che equivalgono a 1772 g di alcol al 70% (88,6 g X 20 fiale).
Ci sono anche casi in cui hai bisogno di alcol ottenuto da una farmacia (95-, 96- percentuale) convertire a 70- percentuale (ad esempio, quando durante l'inventario si stabilisce che l'alcol è effettivamente disponibile nel reparto 70- percentuale, mentre secondo i dati contabili si tiene conto dell'alcol 96- percentuale).
Considera un caso del genere peresempio .
Durante l'inventario presso il dipartimento LPZ, è stato stabilito che in realtà c'è il 70% di alcol nella quantità di 5 kg, mentre secondo i dati contabili ci sono 5 kg di alcol al 96,1%.
Ricordiamo che la forza dell'alcol viene misurata con un dispositivo speciale: un alcolometro.
Per determinare i risultati di tale inventario, è necessario utilizzare la tabella - Quantità in massa (in g) di acqua e alcol etilico con una concentrazione di 96,1 - 96,7%, che devono essere miscelate per ottenere 1 kg di alcol etilico con una concentrazione di 20, 30, 40, 50, 60, 70, 80, 90 , 95, 96 %, che è un'appendice all'istruzione n. 197 .
Quindi, usando la tabella, determiniamo che per ottenere 1 kg di alcol al 70% sono necessari 0,664 kg di alcol al 99,1%.
Pertanto, 5 kg di alcol al 70% corrispondono a 3,32 kg di alcol al 96,1% (5 X 0,664). La carenza di alcol al 96,1% in questo caso è di 1,68 kg (5 kg - 3,32 kg).
Prestiamo inoltre particolare attenzione al fatto che LPZ Non ne hanno il diritto diluire autonomamente l'alcol e ottenere le soluzioni necessarie per l'attività. SecondoArte. 2 Legge n. 481 la produzione di alcol etilico (anche come medicinale) può essere effettuata solo presso imprese statalicon apposita licenza .
CARATTERISTICHE DI CONTABILITÀ PER FILM A RAGGI X
Nella LPZ, per gli esami radiografici dei pazienti, viene utilizzatopellicola a raggi X .
Di norma, alla LPZ vengono fornite pellicole radiografiche di formati standard, vale a dire: 30x40 e 24x30, il che rende impossibile condurre esami radiografici individuali, che richiedono pellicole radiografiche di formati più piccoli. Ciò porta al fatto che per ottenere il formato pellicola richiesto (20x30, 15x24, 15x20, ecc.), i tecnici di laboratorio a raggi X devono tagliare . In questi casi, ti consigliamola procedura e i formati di tale "taglio" del film devono essere approvati dal capo dell'istituzione .
Tuttavia, va ricordato che il reparto contabilità registra il film radiografico nel formato in cui è entrato nell'istituto. A questo proposito, al momento della presentazione della relazione al responsabile finanziario, è necessario indicare i dati sull'uso della pellicola radiografica nello stesso formato in cui è stata ricevuta dall'ente prima del "taglio". Pertanto, la persona finanziariamente responsabile deve contare attentamente i film di quei formati che sono stati ricevuti dopo il "taglio" e calcolare il numero totale di film usati nei formati ricevuti dall'istituzione (30x40, 24x30). L'uso effettivo della pellicola radiografica, riflesso nel Rapporto, deve essere confermato dai dati del Journal of Recording X-ray Examinations (Modulo n. 050/o). La forma di questo giornale è approvatanumero d'ordine 369.
Se nel Rapporto il numero di fogli di pellicola radiografica utilizzati è indicato in più rispetto al numero indicato nel registro dell'esame radiografico, tale pellicola è considerata cancellata. irragionevolmente , che porta a spesa illecita di fondi pubblici.
Le caratteristiche della contabilizzazione di una pellicola fluorografica sono simili alla contabilizzazione di una pellicola radiografica.
CARATTERISTICHE DELLA CONTABILITÀ DEI REAGENTI CHIMICI
Per condurre ricerche sullo stato di salute dei pazienti, alcune strutture sanitarie includono laboratori: diagnostici clinici, batteriologici, biochimici e altri. Gli assistenti di laboratorio conducono ricerche utilizzando una varietà disostanze chimiche , mezzi nutritivi, preparati batteriologici, che hanno principalmente un costo elevato. Ad oggi, non ci sono norme legislative approvate per la loro cancellazione, a causa del gran numero di varietà di reagenti. Quando si utilizzano reagenti chimici e altri preparati destinati alla ricerca, gli assistenti di laboratorio devono osservare standard approvati da istruzioni per il loro uso, che sono fornite dalle organizzazioni di produzione. Gli standard per l'uso di reagenti chimici, di regola, vengono applicati in base auno studio (analisi). Inoltre, possono essere presi in considerazione gli standard per l'uso dei reagenti per le prove di apparecchiature di laboratorio e altri scopi previsti dagli standard di ricerca di laboratorio.
Pertanto, come nel caso delle pellicole radiografiche, nella compilazione del Rapporto, le persone finanziariamente responsabili dovrebbero tenere conto che il numero di reagenti chimici utilizzati deve corrispondere al numero di studi (analisi) eseguiti e ad altri fatti normativi sull'uso di reagenti indicati nei log di analisi, secondo le norme per il loro utilizzo.
Se la quantità di reagenti chimici e altri preparati di laboratorio utilizzati per la ricerca indicata nel rapporto supera la quantità secondo il registro di analisi, tale differenza viene cancellatairragionevolmente .
FARMACI SCADUTI E VERSATI
Se nella ZLP vengono trovati medicinali avariati o scaduti, vengono innanzitutto chiarite le ragioni del loro deterioramento e vengono identificate le persone responsabili di questa situazione.
I medicinali di scarsa qualità sono soggetti al ritiro dalla circolazione ai sensi dell'artOrdine n. 497 . Tali medicinali non sono soggetti a ulteriore uso e vendita edevono essere smaltiti o distrutti .
Si segnala che è accertata la presenza in circolazione di medicinali di bassa qualità o contraffatti, compresi quelli la cui data di scadenza è scadutaautorità statali per il controllo della droga e funzionari (autorizzati) di entità commerciali nel campo della circolazione dei medicinali. Viene registrato il fatto della presenza di farmaci di bassa qualitàatto .
Come definito inRegolamento n. 349 , la procedura per l'esecuzione, la scelta di un metodo per la distruzione dei medicinali che non soddisfano i requisiti stabiliti dalla documentazione analitica e normativa, sono determinati in conformità con i requisiti previsti dalle norme sanitarie statali, tenendo conto del loro pericolo per salute pubblica e ambiente.
I medicinali di scarto vengono ritirati dalla circolazione restituendoli all'entità aziendale (fornitore o produttore) specificato nella decisione o nell'ordine delle autorità statali di controllo dei farmaci di ritirare il medicinale dalla circolazione. Un'entità commerciale che, conformemente alla decisione di ritirare un medicinale dalla circolazione, riceve medicinali di scarto,effettua a proprie spese operazioni di smaltimento o distruzione .
Nota che a rifiuti medicinali i fondi includono:
Medicinali per i quali è scaduta la data di scadenza (secondo i dati indicati nel certificato di qualità e sulla confezione del produttore della corrispondente serie del medicinale);
Medicinali di scarsa qualità ritirati dalla circolazione;
Medicinali che hanno subito effetti meccanici, chimici, fisici, biologici o di altro tipo che ne rendano impossibile l'ulteriore utilizzo;
Medicinali non registrati, salvo quanto previsto dall'attuale legislazione ucraina;
Medicinali per i quali sono state identificate proprietà pericolose precedentemente sconosciute, è stata registrata una reazione avversa grave o un evento avverso grave;
Medicinali contraffatti.
Al ricevimento di medicinali nell'ambito dell'assistenza caritatevole o umanitaria, in caso di rilevamento di medicinali di scarsa qualità o medicinali la cui data di scadenza è scaduta, l'organismo statale di controllo dei medicinalidecide di vietare questi medicinali per uso medico e di ritirarli dalla circolazione.
Per la distruzione di medicinali di bassa qualità, comemetodi, come:
incapsulamento;
inertizzazione;
Metodi termici (combustione ad alta temperatura, pirolisi);
neutralizzazione chimica;
Autoclavaggio (per preparati contenenti cellule viventi e spore di microrganismi);
Il metodo di diluizione con acqua e scarico in una fogna comunale (può essere applicato a medicinali liquidi di scarto a bassa tossicità).
Il fatto della distruzione dei medicinali di scarto è documentatoatto secondo il modello fornitoapplicazione a Regolamento n. 349 . Copia dell'atto entro due settimane è inviato all'autorità statale di controllo della droga, con decisione di cui il farmaco è stato ritirato dalla circolazione.
Secondo clausola 3.9 del Regolamento n. 349 i medicinali legati a sostanze tossiche, compresi i prodotti biotecnologici e gli agenti biologici (vaccini, sieri), gli antibiotici, vengono distrutti in luoghi appositamente designati o presso strutture per la gestione dei rifiuti, fermo restando il rispetto delle norme sanitarie e la disponibilità di autorizzazione del servizio sanitario ed epidemiologico statale , nonché previa autorizzazione di organi esecutivi appositamente autorizzati ai sensi dell'artDecreto n. 440 e Regolamento n. 349 .
Come puoi vedere, la modalità di sequestro e distruzione di medicinali di bassa qualità è piuttosto complicata, pertanto tali casi non dovrebbero essere consentiti nelle attività del LPP.
Va ricordato che secondo clausola 10 dell'istruzione n. 747 il capo dell'istituto è personalmente responsabile per l'uso razionale e la contabilizzazione dei medicinali, la creazione di condizioni idonee alla loro conservazione e, di conseguenza, sarà responsabile della presenza di medicinali di scarto in circolazione.
Per ora, è tutto ciò di cui volevo parlare. Se voi, cari lettori, avete ulteriori domande sul tema della contabilità dei medicinali, inviatele alla redazione del quotidiano Budget Accounting e vi aiuteremo sicuramente a trovare le risposte.
Regolamenti
diritto contabile - Legge dell'Ucraina "Sulla contabilità e rendicontazione finanziaria in Ucraina" del 16 luglio 1999, n. 996-XIV.
Legge sugli stupefacenti - Legge dell'Ucraina "Sugli stupefacenti, le sostanze psicotrope ei precursori" del 15 febbraio 1995, n. 60/95-VR.
Legge sulle licenze - Legge dell'Ucraina "Sulla licenza di determinati tipi di attività economiche" del 1 giugno 2000, n. 1775-III.
Legge n. 481 - Legge dell'Ucraina "Sulla regolamentazione statale della produzione e della circolazione di alcol etilico, cognac e di frutta, bevande alcoliche e prodotti del tabacco" del 19/12/95 n. 481/95-BP.
Decreto n. 1404 - risoluzione del Gabinetto dei ministri dell'Ucraina "Questioni di pagamento anticipato per beni, lavori e servizi acquistati per fondi di bilancio" del 09.10.2006 n. 1404.
Decreto n. 1755 - Decreto del Consiglio dei ministri dell'Ucraina "Sul periodo di validità di una licenza per svolgere determinati tipi di attività economica, l'importo e la procedura per il calcolo delle tasse per la sua emissione" del 29 novembre 2000 n. 1755.
Decreto n. 440 - Decreto del Consiglio dei ministri dell'Ucraina "Approvazione della procedura per l'ottenimento di un'autorizzazione per la produzione, lo stoccaggio, il trasporto, l'uso, la sepoltura, la distruzione e lo smaltimento di sostanze velenose, compresi i prodotti biotecnologici e altri agenti biologici" del 20 giugno, 1995 n. 440.
Elenco n. 770 - Elenco degli stupefacenti, delle sostanze psicotrope e dei precursori, approvato dal Consiglio dei Ministri del 6 maggio 2000 n. 770.
Ordine n. 1295 - La procedura per la distribuzione dei beni ricevuti come assistenza caritatevole, e il controllo sulla distribuzione mirata dell'assistenza caritatevole sotto forma di servizi resi o di lavoro svolto, approvata dal Consiglio dei Ministri 17 agosto 1998 n. 1295.
Ordine n. 1387 - La procedura per l'autorizzazione delle attività relative alla circolazione di stupefacenti, sostanze psicotrope e precursori, approvata dal Consiglio dei Ministri 05 dicembre 2007 n. 1387.
Ordine n. 589 - La procedura per l'attuazione delle attività relative alla circolazione di stupefacenti, sostanze psicotrope e precursori, e il controllo sulla loro circolazione, approvata con Delibera del Consiglio dei Ministri 03 giugno 2009 n. 589.
Elenco n. 7 - L'elenco degli stupefacenti, delle sostanze psicotrope, dei loro analoghi e precursori soggetti a un controllo speciale in conformità con la legislazione dell'Ucraina, approvato dall'ordinanza del Comitato per il controllo della droga del Ministero della Salute dell'Ucraina del 23 marzo 1998 n. 7.
Ordine n. 11 - La procedura per la circolazione di stupefacenti, sostanze psicotrope e precursori nelle istituzioni sanitarie dell'Ucraina, approvata con ordinanza del Ministero della Salute dell'Ucraina del 21 gennaio 2010 n. 11.
Istruzione n. 747 - Istruzioni per la contabilizzazione di medicinali, medicazioni e prodotti medici nelle istituzioni mediche che fanno parte del bilancio statale dell'URSS, approvate con ordinanza del Ministero della Salute dell'URSS del 02.06.87 n. 747.
Istruzione n. 125 - Istruzioni per la contabilizzazione degli stock delle istituzioni di bilancio, approvate con ordinanza del Tesoro dello Stato dell'Ucraina del 08.12.2000 n. 125.
Istruzione n. 197 - Istruzioni per la preparazione in farmacia di forme farmaceutiche con un mezzo di dispersione liquido, approvate con ordinanza del Ministero della Salute dell'Ucraina del 07.09.93 n. 197.
Ordine n. 130 - Ordine del Tesoro dell'Ucraina "Sull'approvazione dei moduli standard di contabilità e cancellazione degli inventari delle istituzioni di bilancio e istruzioni per la loro compilazione" del 18 dicembre 2000 n. 130.
Ordine n. 573 - Ordine del Ministero della Salute dell'Ucraina "Sulla razionalizzazione dell'uso di moduli contabili rigorosi" del 07.10.2008 n. 573.
Ordine n. 210 - Ordine del Ministero della Salute dell'Ucraina "Sull'approvazione dei criteri per la classificazione degli stupefacenti (psicotropi) contenenti una piccola quantità di stupefacenti o sostanze psicotrope e precursori come farmaci da banco, e l'elenco di questi farmaci" del 14 maggio 2003 n. 210 .
Ordine n. 369 - Ordine del Ministero della Salute dell'Ucraina "Sull'approvazione dei moduli delle cartelle cliniche utilizzate negli ospedali e nei policlinici (ambulatori)" del 29 dicembre 2000 n. 369.
Ordine n. 245 - Ordine del Ministero della Salute dell'URSS "Sulle norme per il consumo di alcol etilico per le istituzioni sanitarie, educative e di sicurezza sociale" del 30.08.91 n. 245.
Regolamento n. 360 - Regole per la redazione di prescrizioni e requisiti per l'ordinazione di medicinali e dispositivi medici, approvate con ordinanza del Ministero della Salute dell'Ucraina del 19 luglio 2005 n. 360.
Regolamento n. 349 - Regole per lo smaltimento e la distruzione di medicinali di bassa qualità, approvate con ordinanza del Ministero della Salute dell'Ucraina del 08.07.04 n. 349.
Ordine n. 497 - La procedura per il divieto (sospensione) e il ritiro dalla circolazione dei medicinali sul territorio dell'Ucraina, approvata con ordinanza del Ministero della Salute dell'Ucraina del 12.12.2001 n. 497.
Requisiti n. 216- Requisiti degli impianti e dei locali destinati all'attuazione delle attività per la circolazione di stupefacenti, sostanze psicotrope, precursori e lo stoccaggio di tali stupefacenti e sostanze sequestrate alla circolazione illecita, approvati con ordinanza del Ministero dell'Interno del 15 maggio 2009 n. 216.
Ente sanitario di bilancio statale. Nell'istituto non è presente una farmacia. I medicinali sono rilasciati dalla caposala ai reparti ospedalieri e agli ospedali distrettuali sulla base di un obbligo di fattura. (f. 0315006) per le esigenze dell'istituto (f. .0504210) dovrebbe essere redatto?
Risposta
Come regola generale, in contabilità e tener conto nell'ambito delle rimanenze (clausola, Istruzioni per il Piano Unico dei Conti n. 157n). Tenere i registri dei medicinali nel libro di inventario () o nella scheda di inventario () utilizzando pagine separate per ciascun articolo di medicinale (approvato). Se i medicinali sono trasferiti a persone finanziariamente responsabili in un istituto, il trasferimento di medicinali dovrebbe essere formalizzato spostandoli tra persone finanziariamente responsabili all'interno dell'istituzione, con l'emissione di un obbligo di fattura (). tra persone finanziariamente responsabili, riflette nell'analitica registri contabili a 0.105.31.000 "Medicinali e medicazioni - altri beni mobili dell'ente" modificando la persona finanziariamente responsabile. Va notato che secondo la clausola 119 dell'Ordine del Ministero delle Finanze della Russia del 12.01.2010 n. 157n "la contabilità analitica degli inventari viene effettuata dai loro gruppi (tipi), nomi, varietà e quantità, nel contesto di persone finanziariamente responsabili e (o) luoghi di stoccaggio" nel libro contabile per i beni materiali () o in una scheda contabile per i beni materiali () utilizzando pagine separate per ciascun farmaco.
Registrare la cancellazione delle rimanenze durante la messa in esercizio (a seconda della loro tipologia) sulla base dell'atto sulla cancellazione delle rimanenze () Questa procedura è stabilita anche dalle Linee guida per i moduli,
L'attuale legislazione che disciplina i rapporti nella circolazione dei medicinali nella Federazione Russa è la legge federale n. 61-FZ del 12 aprile 2010 "Sulla circolazione dei medicinali" e le regole per la distruzione di medicinali scadenti, medicinali contraffatti e medicinali contraffatti, approvato dal Decreto del Governo della Federazione Russa del 09.03.2010 N 674 (di seguito denominato Regolamento). La legge federale n. 61-FZ prevede requisiti generali relativi alla procedura e ai motivi per la distruzione di medicinali in una struttura medica. In particolare, l'art. 59 della legge federale N 61-FZ, vengono identificati i tipi di farmaci soggetti a distruzione: farmaci scadenti, farmaci contraffatti, farmaci contraffatti. Tutti i tipi di questi medicinali sono soggetti a ritiro da parte dell'organizzazione - il proprietario dei medicinali dalla circolazione civile e ulteriore distruzione. La procedura per la distruzione di tali farmaci è stabilita nel Regolamento.
Va notato che tutti i medicinali scaduti sono considerati medicinali di scarsa qualità, pertanto, in conformità con le Regole, sono anche soggetti a cancellazione e ulteriore distruzione. Dal momento in cui è venuta a conoscenza della presenza di farmaci scaduti, fino all'ottenimento del permesso di cancellarli, il proprietario dei medicinali deve rimuoverli dal luogo di conservazione e metterli in forma sigillata in una zona di quarantena (clausola 5 , articolo 5 della Legge della Federazione Russa del 02.07.1992 N 2300-1 "Sulla protezione dei consumatori", clausola 12 delle Regole per la conservazione dei medicinali, approvata dall'Ordine del Ministero della Salute e dello Sviluppo Sociale della Russia del 23.08 .2010 N 706n).
Il Ministero delle finanze russo, nella lettera n. 03-03-06/1/24154 del 26 giugno 2013, ha spiegato che il costo dei beni scaduti, nonché i costi del loro smaltimento o distruzione, possono essere presi in considerazione come spese. Contestualmente richiama l'attenzione sul fatto che le spese devono essere conformi alle prescrizioni del comma 1 dell'art. 252 del Codice Fiscale della Federazione Russa, ovvero da documentare.
Il comma 49 dell'art. 270 del Codice Fiscale della Federazione Russa stabilisce che nel determinare la base imponibile, le spese che non soddisfano i criteri specificati nel paragrafo 1 dell'art. 252 del Codice Fiscale della Federazione Russa.
I medicinali scadenti sono identificati durante l'inventario e redatti da un atto di inventario degli articoli di inventario (articolo 11 della legge N 402-FZ, clausola 22 delle Linee guida metodologiche per gli inventari contabili, approvati con decreto del Ministero delle finanze russo del dicembre 28, 2001 N 119n, clausola 27 del Regolamento in materia di contabilità e rendicontazione finanziaria nella Federazione Russa, approvato con decreto del Ministero delle finanze russo del 29 luglio 1998 N 34n).
La procedura per la conduzione e l'elaborazione dei risultati dell'inventario è stabilita dalle Linee guida per l'inventario delle proprietà e degli obblighi finanziari, approvate dall'ordinanza del Ministero delle finanze russo del 13 giugno 1995 N 49 (di seguito - le Linee guida per l'inventario ). I risultati dell'inventario sono registrati in documenti nelle forme approvate dai decreti del Comitato statale di statistica della Russia del 27 marzo 2000 N 26 e del 18 agosto 1998 N 88, con decreto del Ministero delle finanze della Russia di giugno 13, 1995 N 49.
Allo stesso tempo, si segnala che, in virtù dell'art. 9 della Legge N 402-FZ, non è obbligatorio l'utilizzo dei moduli dei documenti contabili primari contenuti negli albi dei moduli unificati dei documenti contabili primari. Pertanto, l'organizzazione - il proprietario dei medicinali ha il diritto di sviluppare il proprio modulo per la cancellazione di medicinali scadenti, indicando tutti i dettagli necessari indicati nell'art. 9 della Legge N 402-FZ, e approvarlo con atto interno, nonché indicare il nome, la forma farmaceutica, il dosaggio, l'unità di misura, la serie, la quantità, nonché le indicazioni relative al contenitore o all'imballaggio, il nome del produttore di medicinali, la data di scadenza.
La sezione 2 delle Linee guida per l'inventario stabilisce le regole generali per l'inventario.
Le forme di registrazione dell'inventario sono approvate e sono riportate nelle Appendici 1 - 18 delle Linee guida metodologiche per l'inventario.
L'inventario degli articoli di magazzino (inventario e materiali) viene effettuato secondo il modulo stabilito N inv-3. Questo modulo ha lo scopo di riflettere le deviazioni dell'effettiva disponibilità di oggetti di valore dalle credenziali, tuttavia, nel caso in esame, non ci sono tali deviazioni (i medicinali scaduti sono disponibili, sebbene siano soggetti a cancellazione a causa della loro inidoneità all'uso ulteriore vendita e utilizzo). Pertanto, se l'organizzazione - il proprietario dei medicinali ha medicinali scadenti, si consiglia di includerli meglio in un elenco di inventario separato, indicando in esso: nome, forma di dosaggio, dosaggio, unità di misura, serie, quantità, nonché informazioni su contenitori o imballaggi, nome del produttore del farmaco, data di scadenza.
Inoltre, le organizzazioni che vendono farmaci con una data di scadenza stabilita devono monitorare costantemente le date di scadenza e ritirare i farmaci dalla circolazione una volta scaduta la data di scadenza indicata dal produttore farmaceutico sull'etichetta. Quando si cancellano dal registro i medicinali scaduti o avariati, l'organizzazione - il proprietario dei medicinali può anche utilizzare i moduli unificati N TORG-15 "Azione su danni, distruzione, rottami di articoli di inventario" e N TORG-16 "Azione sulla scrittura -fuori merce”, a condizione che siano approvati dal principio contabile dell'organizzazione.
In futuro, i medicinali scadenti devono essere distrutti dall'organizzazione, il proprietario dei medicinali in conformità con le Regole.
Pertanto, secondo il paragrafo 10 del Regolamento, il proprietario di medicinali di scarsa qualità, che ha deciso di ritirarli, distruggerli ed esportarli, trasferisce questi medicinali all'organizzazione che li distrugge, sulla base di un accordo appropriato. I costi associati alla distruzione di medicinali scadenti sono rimborsati dal loro proprietario (clausola 9 del Regolamento).
Pertanto, quando si cancellano medicinali scadenti, l'organizzazione - il proprietario dei medicinali deve seguire la procedura regolata dalle Linee guida metodologiche per l'inventario. L'intero processo di inventario deve essere registrato in documenti, le cui forme sono approvate dall'organizzazione nel modo prescritto. Quando vengono identificati medicinali scadenti, devono essere indicate informazioni obbligatorie che consentano di identificarli durante la cancellazione. In particolare, il rapporto di cancellazione deve riportare il nome, la forma farmaceutica, il dosaggio, l'unità di misura, la serie, la quantità, nonché le informazioni sul contenitore o sulla confezione, il nome del produttore del medicinale, la data di scadenza.
Se i requisiti di cui sopra (convalida e prove documentali) sono soddisfatti, i costi associati alla distruzione dei medicinali possono essere presi in considerazione come spese ai fini dell'imposta sul reddito.
Inoltre, notiamo che è stata la prova documentale delle spese che è stata prestata attenzione dai giudici della FAS del distretto di Mosca (decreto del 28 maggio 2014 nel caso N A40-115533 / 13). In particolare, il tribunale ha evidenziato che dai certificati presentati di danneggiamento, distruzione, rottame (farmaco) (Modulo N TORG-15) non è possibile trarre conclusioni sulla natura del vizio che ha causato la distruzione del farmaco; negli atti di distruzione dei medicinali, il luogo di distruzione dei medicinali, le informazioni sui medicinali distrutti (nome, forma farmaceutica, dosaggio, unità di misura, serie) e la loro quantità, nonché il contenitore o l'imballaggio, il nome del produttore di medicinali non sono indicate, cioè non sono indicate informazioni obbligatorie per identificare i medicinali svalutati. Inoltre, come ha rilevato il giudice, gli atti depositati contengono, in relazione ai medicinali contestati, diverse motivazioni della distruzione e discrepanze quantitative, e tali contraddizioni non sono state eliminate in sede istruttoria ed esame della causa, pur incidendo, tra l'altro il calcolo dell'ammontare delle spese che compongono il costo dei farmaci distrutti. La corte ha inoltre osservato che possono essere cancellati solo i medicinali con una durata di conservazione scaduta, ma non i medicinali con una durata di conservazione residua bassa. A causa delle circostanze di cui sopra, all'organizzazione medica è stato negato il riconoscimento delle spese sostenute per il calcolo dell'imposta sul reddito.
Nell'ambito della presente causa, i tribunali hanno anche citato un possibile insieme di documenti che confermano le spese del contribuente relative alla distruzione di medicinali scaduti al fine di ridurre l'imposta sul reddito, si tratta di: un atto di inventario delle voci di magazzino; la decisione del proprietario di medicinali scadenti sul loro ritiro, distruzione; un accordo con un'organizzazione che distrugge i medicinali; una copia della licenza dell'organizzazione che effettua la distruzione di medicinali, per il diritto di svolgere tali attività; documento principale che conferma il trasferimento di medicinali per la distruzione; un atto sulla distruzione dei medicinali (cfr. Risoluzione della Nona Corte d'Appello Arbitrale del 28 febbraio 2014 N 09AP-1072/2014 nella causa N A40-115533/13).
Il Ministero delle finanze russo, nella lettera n. 03-03-06/1/66948 del 24 dicembre 2014, ha indicato che una prova documentale sufficiente dei costi sostenuti dal contribuente per la distruzione dei prodotti scaduti è la presentazione da parte del contribuente dei seguenti documenti: atti (registri) di modifica dello stato delle merci, in cui si riflettono le ragioni per classificare i prodotti come di bassa qualità (data di scadenza); atti di accettazione della merce al momento della restituzione; agisce sull'inventario; atti di distruzione di prodotti di bassa qualità, che contengono informazioni sui nomi e sulla quantità delle merci distrutte, la data di distruzione; estratti dei registri contabili fiscali per la contabilizzazione di beni cancellati in relazione alla loro distruzione.
Pertanto, se il proprietario di medicinali soddisfa i requisiti della legislazione che disciplina i rapporti sulla circolazione dei medicinali nella Federazione Russa, quando redige un atto sulla cancellazione di medicinali scadenti, anche in termini di presenza di informazioni obbligatorie in l'atto, nonché il rispetto dei requisiti della legge N 402-FZ, l'atto specificato, tra gli altri documenti primari di supporto, sarà la prova documentale delle spese ai fini dell'imposta sul reddito relative alla distruzione di medicinali.
Attualmente, non esiste un documento speciale in base al quale i medicinali scadenti verrebbero cancellati. L'organizzazione - il proprietario dei medicinali ha il diritto di sviluppare un proprio modulo per la cancellazione di medicinali scadenti, indicando tutti i dettagli necessari indicati nell'art. 9 della legge federale del 06.12.2011 N 402-FZ "On Accounting" (di seguito denominata legge N 402-FZ), e approvarlo con il suo atto interno, e riflette anche in esso il nome, la forma di dosaggio, il dosaggio, unità di misura, serie, quantità, nonché informazioni sul contenitore o sulla confezione, il nome del produttore del medicinale, la data di scadenza. Oppure puoi utilizzare i moduli unificati N TORG-15 "Legge su danni, distruzione, rottami di articoli di inventario" e N TORG-16 "Legge sulla cancellazione delle merci", approvato con decreto del Comitato statale di statistica della Russia datato 25 dicembre 1998 N 132.
Tali atti, insieme ad altri documenti forniti nella motivazione, costituiscono prova documentale dei costi connessi alla distruzione dei medicinali ai fini dell'imposta sul reddito.
Le attività di alcune organizzazioni, ad esempio farmacie, cliniche, studi medici privati, ecc., sono associate all'uso e alla vendita di medicinali (MP). Come ogni prodotto, devono essere venduti o utilizzati in tempo, il produttore indica una data di scadenza valida per questo. Tuttavia, sono inevitabili situazioni in cui una parte dei farmaci rimarrà sugli scaffali o in magazzino dopo la scadenza di questo periodo. Come agire correttamente in questi casi, come cancellarli e cosa fare con i farmaci scaduti in seguito, lo capiamo in questo articolo.
Scaduto significa scarsa qualità.
Il numero sulla confezione dei medicinali che indica la data di fine del suo utilizzo è molto importante. Anche se, infatti, non succede nulla al contenuto del flaconcino o della scatola nei giorni in più successivi alla data indicata, non è più possibile vendere o assumere tali medicinali.
Arte. 59 della Legge “Sulla circolazione dei medicinali” equipara i farmaci a scadenza a quelli scadenti, sottraendoli alla disciplina di farmacopea. Nell'art. 31 della legge federale n. 86-FZ del 22 luglio 1998, la loro vendita è direttamente e categoricamente vietata.
Dalla data designata cessano di essere medicinali, ma sono considerati beni riciclabili che hanno perso le proprietà di consumo. Come affrontarli ulteriormente è indicato nell'Istruzione approvata dall'Ordine del Ministero della Salute della Russia n. 382 del 15 dicembre 2002. È valido per i seguenti medicinali:
- la cui data di scadenza è scaduta;
- che per qualsiasi motivo sono diventati inutilizzabili;
- falsificazioni;
- medicinali contraffatti;
- falsi ufficialmente registrati nei marchi medicinali della Federazione Russa.
Il regolamento sulla distruzione di tali farmaci è approvato dalla legislazione della Federazione Russa:
- nel decreto del governo della Federazione Russa del 3 settembre 2010 n. 674 - per la maggior parte dei farmaci;
- nell'Ordine del Ministero della Salute della Federazione Russa del 12 novembre 1997 n. 330 - se i farmaci sono psicotropi o narcotici.
Responsabilità dei proprietari di medicinali scadenti
Le persone giuridiche o i singoli imprenditori che possiedono o gestiscono medicinali, ai sensi del paragrafo 2 della suddetta Istruzione, devono eseguire con loro senza fallo le seguenti operazioni:
- Effettuare tempestivamente un inventario e identificare i farmaci che perdono le loro qualità di consumo o che inizialmente non li soddisfano.
- Ritirare immediatamente tali farmaci dalla circolazione e formalizzarli secondo la procedura documentale stabilita.
- Invia i medicinali ritirati per lo smaltimento completo a imprese speciali autorizzate per la loro distruzione.
- Sii presente di persona o invia il tuo rappresentante alla procedura per la distruzione dei farmaci (come parte di una commissione appositamente creata).
NOTA! Lo smaltimento dei farmaci scaduti può essere avviato non solo dalla buona volontà del proprietario, ma anche dalle istruzioni delle autorità di regolamentazione o da una decisione del tribunale.
Come cancellare correttamente i farmaci
La procedura di cancellazione e successivo smaltimento dei medicinali è associata a un supporto documentale abbastanza ampio. Il documento principale è il Write-off Act, che diventerà la base per il trasferimento di medicinali avariati o scaduti per la distruzione. Il processo di identificazione e cancellazione di tali medicinali prevede diversi passaggi importanti:
- Inventario:
- identificazione e fissazione di farmaci scadenti;
- inserimento delle informazioni nei fogli di inventario (con firme dei membri della commissione di inventario e delle persone con responsabilità finanziaria);
- riflesso di tali dati nella documentazione contabile.
I seguenti moduli possono essere utilizzati per registrare i dati sui danni ai farmaci:
- N. TORG-15 e n. TORG-16, approvati dal decreto del Comitato statale di statistica della Russia n. 132 del 25 dicembre 1998 "Sull'approvazione delle forme unificate della documentazione contabile primaria per la contabilità delle operazioni commerciali";
- moduli dalle Linee guida per professionisti e ricercatori, approvate dall'Ordine del Ministero della Salute della Russia n. 98/124 del 14 maggio 1998.
IMPORTANTE! L'atto di cancellazione è il documento principale per lo smaltimento dei medicinali avariati o scaduti. Sulla base, vengono trasferiti a organizzazioni speciali per la distruzione.
Distruzione legale di medicinali
I farmaci che sono diventati scadenti non possono essere semplicemente gettati nella spazzatura. Devono essere consegnati per la distruzione regolamentata dalla legge a società speciali che hanno il permesso di farlo.
Contabilità finanziaria per lo smaltimento dei medicinali
Il proprietario conclude un contratto di servizio con tale organizzazione: servirà come documento di conferma dei costi.
ATTENZIONE! I costi di smaltimento dipendono non solo dalle tariffe dell'azienda, ma anche dalle specificità dello smaltimento di alcuni farmaci: ad esempio, le compresse sono molto più facili da distruggere rispetto ai farmaci aerosol, da qui il maggior costo di smaltimento di questi ultimi. Il costo della distruzione incide anche sull'imballaggio dei medicinali, sul loro peso, volume.
Dopo la distruzione diretta, l'appaltatore emette una fattura per i servizi al cliente, dopo di che viene emesso un certificato di accettazione per il lavoro svolto (di solito è standard).
Il codice fiscale prescrive che queste spese siano prese in considerazione nel calcolo dell'imposta sul reddito (clausola 1, articolo 264 del codice fiscale della Federazione Russa).
È possibile distruggere le medicine da soli
La legge consente l'autosmaltimento dei medicinali da parte dei loro proprietari, alle seguenti condizioni:
- il proprietario non è un produttore di farmaci;
- il lotto da smaltire ha un volume ridotto.
Molto spesso questa situazione si verifica nelle farmacie.
È necessario smaltire i medicinali nell'ordine stabilito dall'Istruzione, determinato per ogni tipo di medicinale distrutto:
- i medicinali liquidi devono essere fortemente diluiti con acqua (non inferiore a 1:100) e versati nelle fognature;
- le compresse che si sciolgono in acqua devono essere macinate in polvere, anch'essa sciolta in acqua e versata;
- gli unguenti e le forme di dosaggio insolubili devono essere bruciati;
- frammenti di ampolle, scatole, convales, bottiglie, ecc. vengono smaltiti come rifiuti domestici (buttati via)
NOTA! Se le sostanze da distruggere sono esplosive o infiammabili, il loro autosmaltimento è vietato.
Atto di distruzione
Dopo lo smaltimento, i membri della commissione compilano un atto speciale. Dovrebbe includere le seguenti informazioni:
- data di smaltimento;
- il luogo in cui è successo;
- dati di tutti i membri della commissione di distruzione (nome, posizione, luogo di lavoro);
- motivi per cui i farmaci vengono inviati allo smaltimento;
- un elenco dei medicinali distrutti (nome, numero di unità, caratteristiche dell'imballaggio, contenitori);
- il nome del titolare dei beni in dismissione (società o singolo imprenditore) e i suoi dati;
- motivazione del metodo di smaltimento (per ciascun medicinale dell'elenco).
ATTENZIONE! L'atto di distruzione deve essere firmato da tutti i membri della commissione e apposto il sigillo dell'impresa di liquidazione.
Dopo la redazione, entro 5 giorni, il presente documento o la sua copia autenticata viene inviato al Servizio federale per la vigilanza sulla salute e lo sviluppo sociale.
Ciò che minaccia i proprietari di droga negligenti
Se nell'arsenale di un ente o di un singolo imprenditore, i medicinali che hanno perso la loro condizione non vengono smaltiti in tempo, per i possessori senza scrupoli dell'art. 14.1 del Codice degli illeciti amministrativi della Federazione Russa prevede una responsabilità grave:
- per un'organizzazione - una multa da 40.000 a 50.000 rubli;
- è possibile sospendere le attività core fino a 3 mesi;
- per un funzionario coinvolto nella vendita di "ritardo" medicinale - una multa da 4.000 a 5.000 rubli.
Il “bonus” sarà la perdita della reputazione dell'ente e, di conseguenza, un calo della domanda e del rispetto da parte dei clienti.